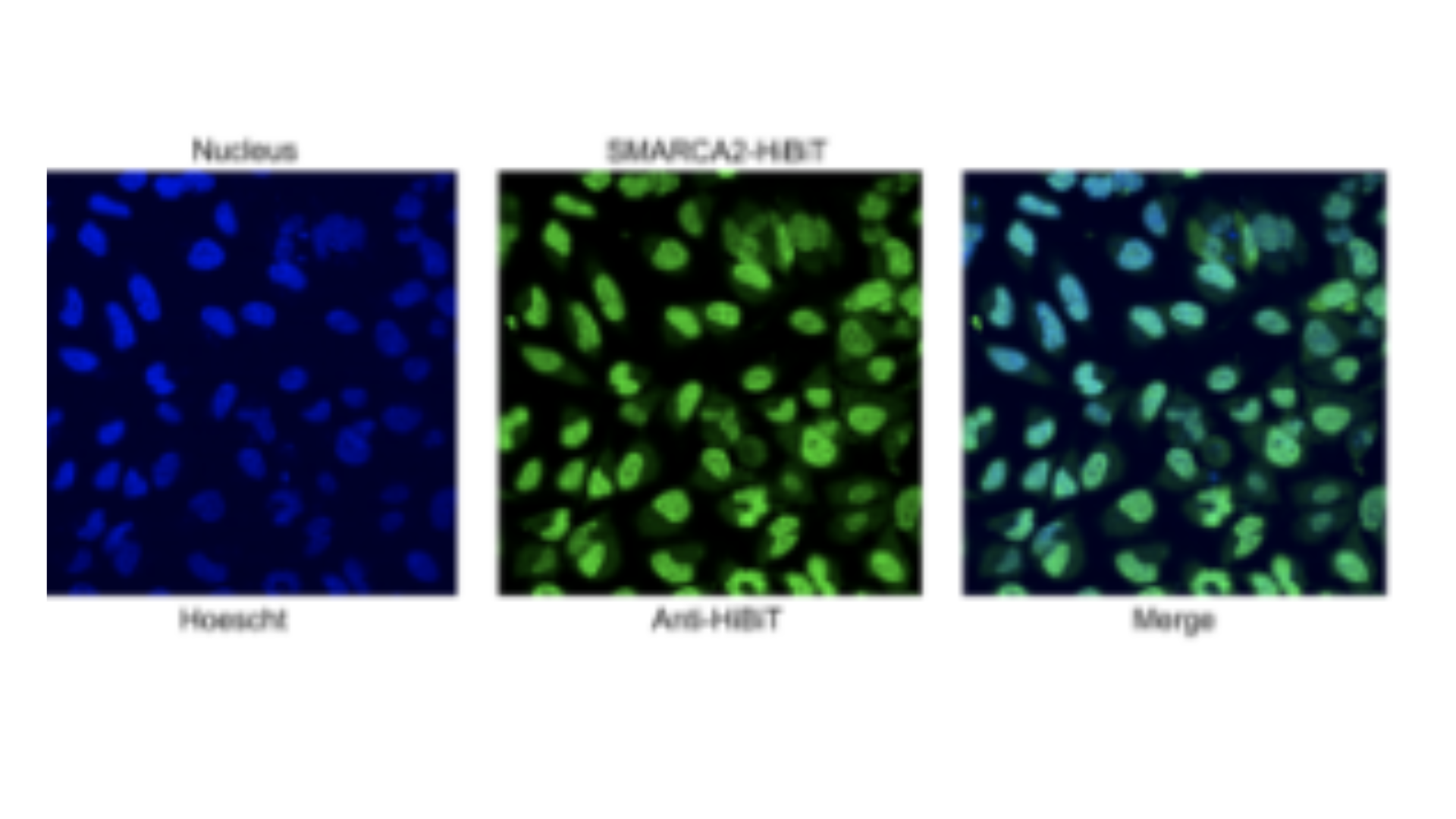
CRISPR/Cas9 ゲノム編集によるタグのノックイン
CRISPR / Cas9 ゲノム編集技術を利用して生物発光タグを標的となる内在性遺伝子座にノックインすることにより、ネイティブプロモーターよるタンパク質の発現を、シンプルな発光測定だけで調べることができます。過剰発現モデルと比較して、内在的にタグ付けされたタンパク質は自然なエピジェネティックな制御を受け、ネイティブな相互作用パートナーとの化学量論が維持されるため、アーチファクトが最小限に抑えられ、生理学的な条件下におけるタンパク質のバイオロジーをより正確に表すモデルとなり、 アッセイウィンドウの改善にもつながります。
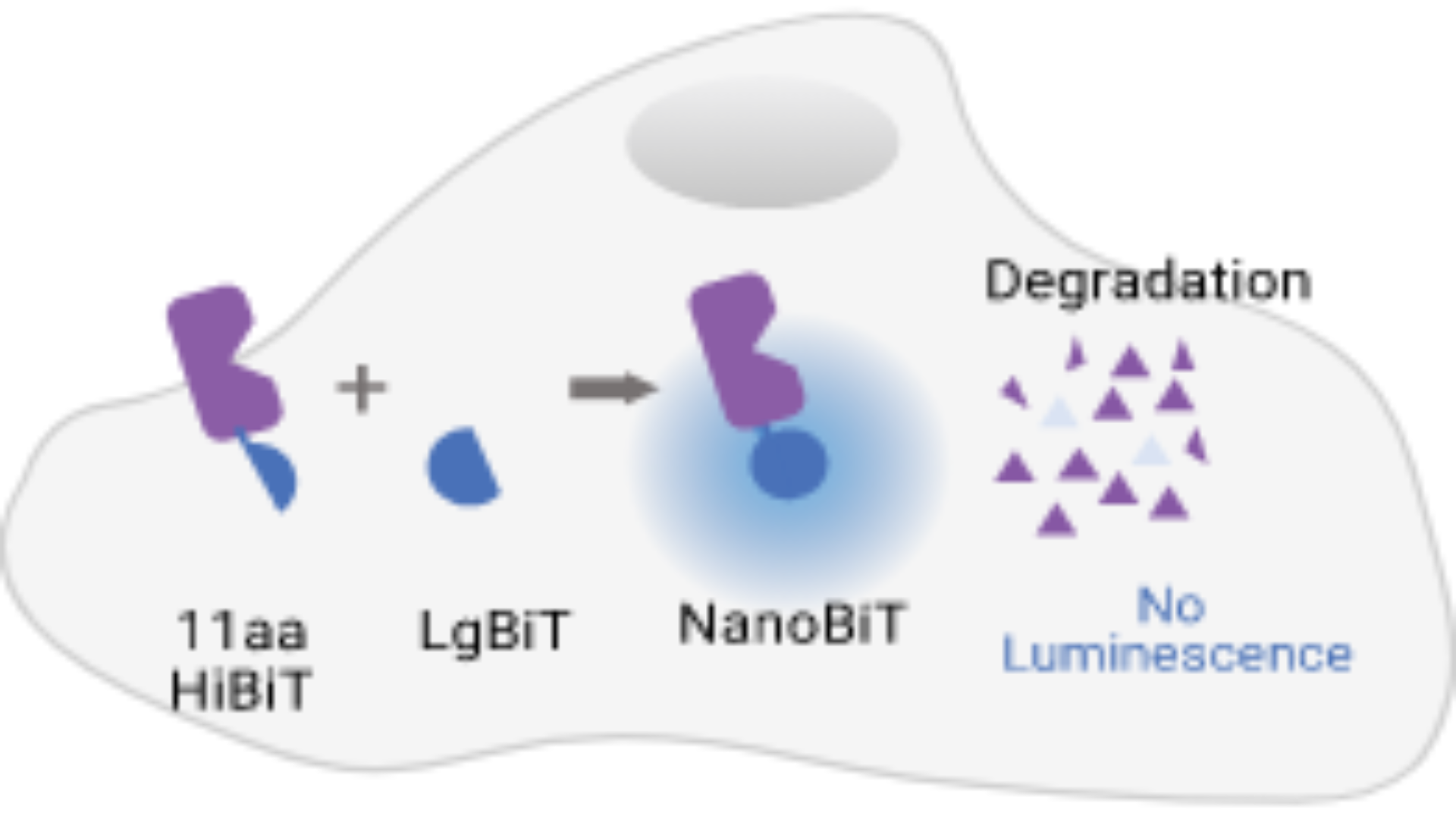
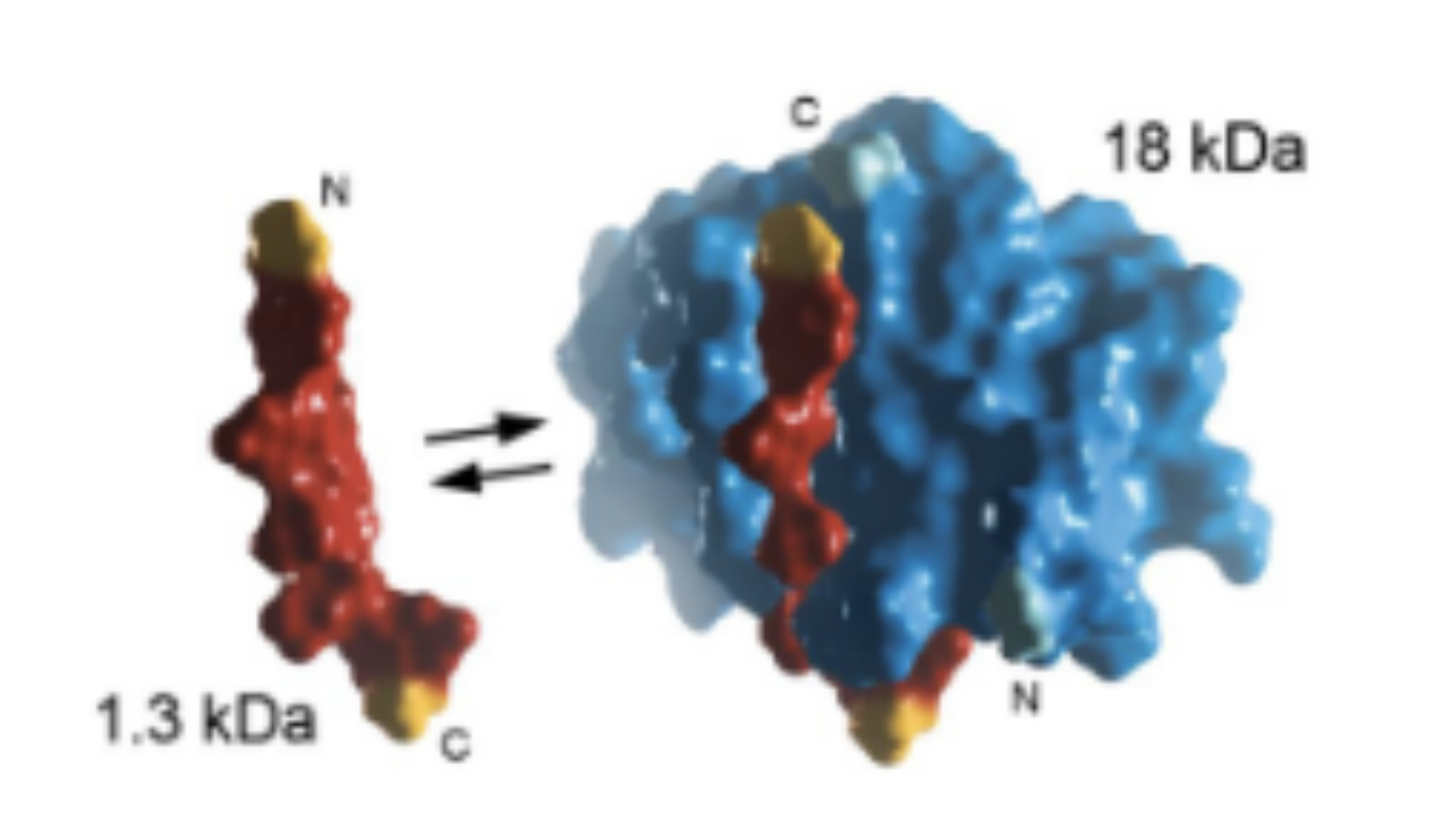
HiBiTは内在性タンパク質を研究する上で非常に有用なタグで、LgBiTと呼ばれる大きなサブユニットに高い親和性で結合する小さな11アミノ酸のペプチドです。結合した複合体は、ルシフェラーゼ活性を有するため、基質の添加により明るい発光シグナルを生成します。HiBiTタグのサイズが非常に小さいため、他のタグに比べてノックイン効率が高く、CRISPR / Cas9 ゲノム編集ワークフローに最適です。
プロメガでは、関心の高いターゲット遺伝子と細胞株の組み合わせで、CRISPR 編集によりタグをノックイン細胞株プールとクローンの包括的なセレクションを提供します。

CRISPRノックインタギングを利用したタンパク質存在量、内在化、制御のモニタリング
調節されたタンパク質存在量の決定
細胞内のタンパク質レベルは、細胞状態の変化によって自然に調整されており、治療戦略として意図的に操作される場合もあります。近年、狙ったタンパク質だけを分解する手法が開発され、これまで標的にできなかったタンパク質へのアプローチを可能にする新しい低分子モダリティとして脚光を浴びています。CRISPR / Cas9 ゲノム編集を利用して生物発光タグを内在的に挿入すると、特異的抗体を必要とすることなくタンパク質存在量を測定することができます。これらのアッセイは感度が高く、エンドポイントフォーマットまたは生細胞フォーマットで測定できるため、内在性の標的タンパク質レベルの詳細な分析が可能になります。
Choose the Path that Best Meets Your Needs

Check out our comprehensive list of 250+ cell line pools and clones for popular targets and cell backgrounds.


Use our detailed protocol to create your own HiBiT knock-in cells. Obtain the HiBiT sequence and synthesis rights and review our terms of use by completing our licensing agreement.
Collaborate with experts who offer custom knock-in and gene-editing services:
EditCo Bio – Provides functionally validated CRISPR-edited cell lines, offering precise and scalable genome engineering solutions to support research in cell and gene therapy, drug discovery, and basic biology.
FUJIFILM CDI – Offers custom knock-in cell line generation using human iPSC-derived cells to create physiologically relevant models for disease research, drug discovery, and cell therapy development.
ALSTEM, Inc. – Delivers custom iPSCs, CRISPR/Cas9-edited cell lines, and viral vectors, supporting research in regenerative medicine, disease modeling, drug discovery, and basic biology.
調節されたタンパク質存在量の決定
細胞内のタンパク質レベルは、細胞状態の変化によって自然に調整されており、治療戦略として意図的に操作される場合もあります。近年、狙ったタンパク質だけを分解する手法が開発され、これまで標的にできなかったタンパク質へのアプローチを可能にする新しい低分子モダリティとして脚光を浴びています。CRISPR / Cas9 ゲノム編集を利用して生物発光タグを内在的に挿入すると、特異的抗体を必要とすることなくタンパク質存在量を測定することができます。これらのアッセイは感度が高く、エンドポイントフォーマットまたは生細胞フォーマットで測定できるため、内在性の標的タンパク質レベルの詳細な分析が可能になります。
CRISPR / Cas9ノックイン技術を利用した内在遺伝子ローカスにおけるタグ付け
CRISPR / Cas9ノックイン技術と生細胞での生物発光検出法の組み合わせにより、目的タンパク質の存在量の変化をリアルタイムでモニタリングして、細胞タンパク質のダイナミクスをより理解することができます。
内在性のタグ付けをおこなう理由とは?
- 生理学的な発現レベルをモニタリング:遺伝子量の影響なし(多量のベクター導入などとは異なり)
- ネイティブなプロモーターとエピジェネティックな制御下にある遺伝子の研究
- ネイティブな相互作用パートナーとの化学量論の維持(過剰発現による生理的相対比からの逸脱とは異なり)

調節されたタンパク質存在量の決定
細胞内のタンパク質レベルは、細胞状態の変化によって自然に調整されており、治療戦略として意図的に操作される場合もあります。近年、狙ったタンパク質だけを分解する手法が開発され、これまで標的にできなかったタンパク質へのアプローチを可能にする新しい低分子モダリティとして脚光を浴びています。CRISPR / Cas9 ゲノム編集を利用して生物発光タグを内在的に挿入すると、特異的抗体を必要とすることなくタンパク質存在量を測定することができます。これらのアッセイは感度が高く、エンドポイントフォーマットまたは生細胞フォーマットで測定できるため、内在性の標的タンパク質レベルの詳細な分析が可能になります。
CRISPRノックインタギングを利用したタンパク質存在量、内在化、制御のモニタリング
調節されたタンパク質存在量の決定
細胞内のタンパク質レベルは、細胞状態の変化によって自然に調整されており、治療戦略として意図的に操作される場合もあります。近年、狙ったタンパク質だけを分解する手法が開発され、これまで標的にできなかったタンパク質へのアプローチを可能にする新しい低分子モダリティとして脚光を浴びています。CRISPR / Cas9 ゲノム編集を利用して生物発光タグを内在的に挿入すると、特異的抗体を必要とすることなくタンパク質存在量を測定することができます。これらのアッセイは感度が高く、エンドポイントフォーマットまたは生細胞フォーマットで測定できるため、内在性の標的タンパク質レベルの詳細な分析が可能になります。
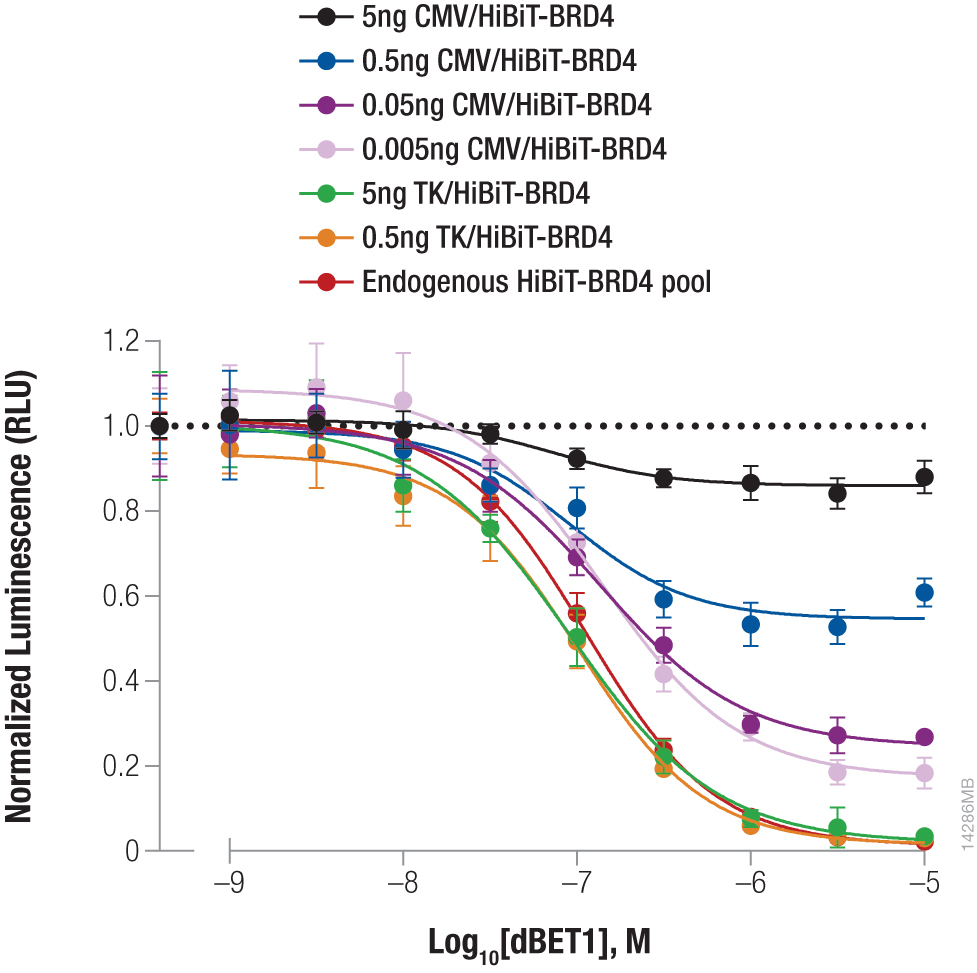
PROTAC処理後の内在性 HiBiT-BRD4の分解カイネティクス. HEK293 LgBiT Cell Line の内在 BRD4 遺伝子座にHiBiTを挿入した。Nano-Glo® Endurazine™ substrate を含むCO2 非依存性培地中で様々な濃度のMZ1で細胞を処理した。発光は GloMax® Discover マイクロプレートリーダーでリアルタイムに測定した。
CRISPR ゲノム編集によるその他のノックインアプリケーション
標的タンパク質の分解
細胞内の特定タンパク質を選択的に除去する方法は新しい治療モダリティとして有望です。
ターゲットエンゲージメント
インタクトな細胞内で標的タンパク質に結合する化合物を測定する高感度なアッセイ法の開発
タンパク質のインターナリゼーションと分泌
受容体の内在化や分泌を簡便、高感度に定量できる生物発光アッセイ
タンパク質のインターナリゼーションと分泌
受容体の内在化や分泌を簡便、高感度に定量できる生物発光アッセイ