T 細胞治療
人工 T 細胞療法は、患者自身の免疫細胞を抗原特異的T細胞受容体(TCR)やキメラ抗原受容体(CAR)で遺伝子改変する方法です(自己免疫療法)。これらの精密に操作された細胞は、患者に再導入されると、腫瘍細胞を認識して殺すよう患者の免疫系に指示します。この分野における将来の進歩には、より洗練された機能的T細胞工学、新しいタイプの細胞療法(NK細胞療法やマクロファージ細胞療法)、既製の細胞療法製品(同種療法)の利用などが含まれます。
機能的に複雑なT細胞療法の開発と製造には、生化学的および細胞ベースのアッセイという、同様に洗練されたツールボックスが必要です。プロメガは、生物発光アッセイ技術の広範なポートフォリオを活用し、以下を可能にする一連のアッセイを開発しました:
- 新規抗原特異的 TCR および CAR の探索
- T細胞の活性化とサイトカイン産生の測定
- ターゲットセルキリング(TCK)アッセイの開発
TCR の開発と特性評価
キメラ抗原受容体(CAR)やトランスジェニック T細胞受容体(TCR)などのT細胞の遺伝子改変による細胞性T細胞リダイレクションは、リダイレクションT細胞療法に採用される重要な戦略の一つであり、がん治療の新たなパラダイムを示すものです。新しいトランスジェニック TCRのスクリーニングと特性解析を容易にするために、CD4+またはCD8+の2つのTCRαβ null レポーターT細胞株を開発しました。ペプチド特異的TCRα鎖およびβ鎖をTCRαβ null レポーターT細胞株に再導入すると、ペプチド依存的にTCRが活性化されます。TCRαβ null レポーターT細胞株におけるCD4またはCD8の選択的発現は、MHCIおよびMHCII制限腫瘍抗原標的の両方に対するトランスジェニックTCRの開発を可能にします。これらの生物発光バイオアッセイは、T細胞ベースの免疫療法の発見と開発のための新しいツールセットです。
我々は、ルシフェラーゼレポーターの NFAT または IL-2 駆動発現を介したTCRシグナル伝達を測定する一連の T Cell Activation Bioassays を開発しました。また、人工 T細胞療法を開発する研究者の利便性を高めるため、内在性TCRαβ鎖の発現を欠くT細胞活性化バイオアッセイも開発しました。 T Cell Activation Bioassay (TCRαβ-KO) は、内在性のα鎖とβ鎖とトランスジェニックTCRとの交差ペアリングを排除し、改良されたアッセイウインドウを提供します。
- トランスジェニックTCRあるいはCARの活性と効力を測定
- 内在性 TCRαβを欠損するバイオアッセイ細胞
- CD4+、CD8+、CD4+CD8+、CD4-CD8-フォーマットが利用可能


T Cell Activation Bioassay(TCRαβ-KO、CD4+)を用いて測定したトランスジェニック TCR の活性. A) TCRαβ-KO(CD4+)細胞を陽性コントロール TCR プラスミドでトランスフェクトし(またはモックトランスフェク ト)、MHCII APC 細胞(HLA-DR+細胞)および濃度を増加させた陽性コン トロールペプチドと共培養した。 B) TCR を介した T 細胞活性化を、T Cell Activation Bioassay(内在性 TCR、CD4+)および T Cell Activation Bioassay(TCRαβ-KO、CD4+)を用いて測定した。T Cell Activation Bioassay の細胞は、HLA-DR陽性細胞および増加する同族ペプチドと共培養した。腫瘍細胞上の抗原と結合することにより改変T細胞が活性化されたことが発光によって示された。このデータは、T Cell Activation Bioassay が、T細胞免疫療法に使用されるトランスジェニックTCRのスクリーニングに使用できることを示している。
T細胞の活性化とサイトカイン産生
サイトカイン、特にIFN-γとIL-2 の産生は活性化された細胞傷害性T細胞の特徴です。我々は、新規の Lumit™ Immunoassay platform を用いたT細胞サイトカインイムノアッセイを開発しました。これらのアッセイは、IL-2やIFN-γのような重要なサイトカインの放出を高感度な生物発光で検出することができます。


Lumit™ イムノアッセイ による活性化 CD8 T細胞から産生する IL-2およびIFN-γ の測定. 精製した CD8+ T細胞(エフェクター細胞)をRaji B 細胞(ターゲット細胞)およびBlincyto®(CD3 x CD19二重特異性 T細胞エンゲージャー)の連続希釈液と混和した。 エフェクター細胞からのサイトカインの放出を検出するために、IFN-γ(A)およびIL-2(B)レベルを Lumit™ Cytokine Immunoassayで測定した。
効力試験
CAR T-細胞療法の有効性を保証するため、CAR T 細胞ががん細胞を認識し、排除する能力を評価する機能的な力価試験が採用されています。プロメガは、細胞医薬(CAR-T 細胞や TCR-T 細胞など)だけでなく、材料(CAR、TCR のベクターやウイルスキャプシド)にも使用できる効力試験を開発しました。CAR-T の機能的効力アッセイでは、CAR T-細胞を標的がん細胞と共培養し、標的細胞の殺傷などの主要な機能的結果を測定します。これらのアッセイは、がん領域におけるCAR T-細胞療法の開発、特性評価、品質管理において重要な役割を果たしています。
ターゲットキリング (TCK)
エフェクター細胞による腫瘍細胞や感染細胞のターゲットセルキリング(標的殺傷)は、多くの免疫療法薬の主要な作用機序です。従って、薬剤の開発においては、ターゲット細胞の強固で特異的な殺傷能力を証明する必要があります。従来の細胞毒性アッセイでは、ターゲット細胞とエフェクター細胞を区別することはできません。さらに、ターゲット細胞特異的アッセイは、多くの場合、手間がかかり、放射性標識や蛍光標識が必要です。
HiBiT ターゲットセルキリング バイオアッセイプラットフォームは、シンプルで高感度なホモジニアスなフォーマットであり、堅牢なアッセイウィンドウを提供します。モノクローナル抗体、二重特異性抗体、CAR-T 細胞を含む様々な生物学的製剤によって誘導されるターゲット細胞の死滅を高感度かつ特異的に測定することができます。これらのアッセイでは、HiBiT 融合タンパク質を発現する一般的なターゲット細胞を選択できます。ターゲット細胞を殺傷すると、明るい発光シグナルが発生します。


インキュベーション時間の延長により明らかになったTCK活性の持続性. CAR-19またはGFPコントロールのレンチウイルスで形質転換したT細胞を、異なるエフェクター:ターゲット(E:T)比でHiBiTターゲット細胞(Ramos)に加えた。24時間 (A) または48時間 (B) インキュベート後、NanoBiT® Extracellular Detection Reagentを添加し、発光をGloMax® Discoverプレートリーダーで読み取った。EC50 は時間の経過とともに左にシフトし、E:T比が低いとTCK活性が持続していることを示している。
T細胞リダイレクト用のレンチ-CARウイルスのインプロセス効力試験
CAR-T 製造に使用されるレンチウイルスベクターについて、規制当局からのガイダンスでは、CAR-T 細胞におけるウイルスベクターの導入遺伝子発現にとどまらず、さらなる効力測定が推奨されています。このニーズに対応するため、我々は T細胞リダイレクト用レンチウイルスベクターのCAR : ターゲット細胞エンゲージメントを測定する作用機序ベースの効力試験を開発しました。このバイオアッセイは、安定性を示す定量的な発光測定法を提供し、CAR-T ワークフローの一部として容易に実施することができます。
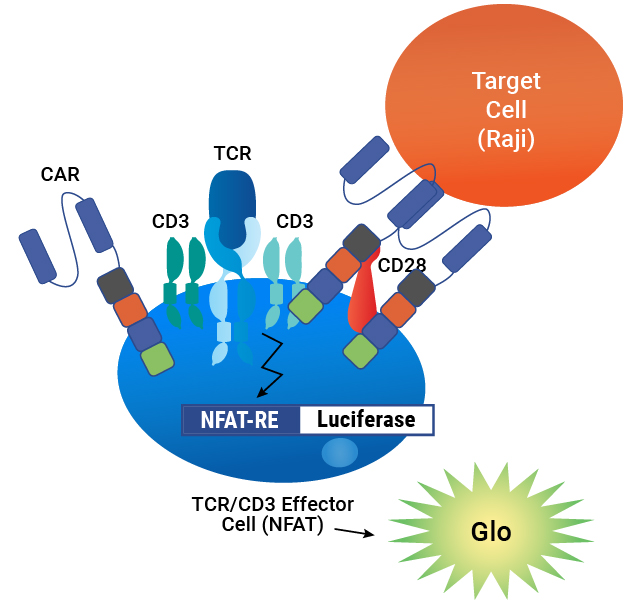
アッセイ原理 . CARは、NFAT-Luciferaseレポーターを含むTCR/CD3エフェクター細胞の表面に発現する。CARがターゲット細胞上の抗原と結合すると、シグナル伝達に比例して発光が誘導される。
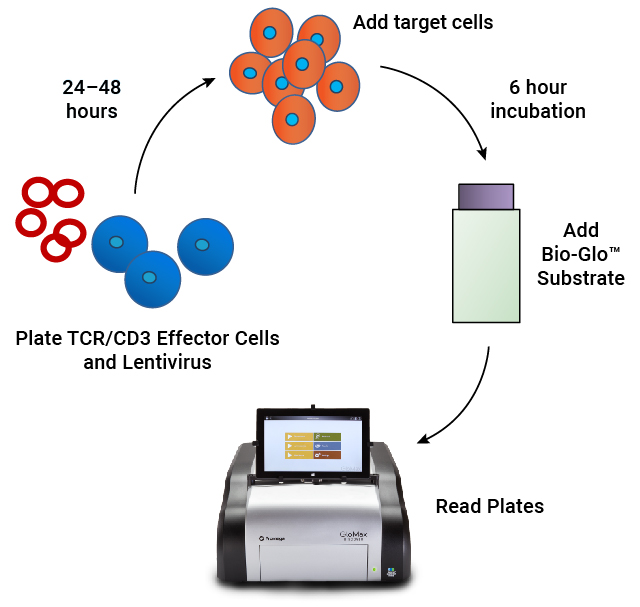
アッセイのワークフロー . 96ウェルプレート中で TCR/CD3エフェクター細胞にCARレンチウイルスを加える。24~48 時間のインキュベーション後、抗原発現ターゲット細胞を加える。6時間の誘導期間後、Bio-Glo™ Substrateを添加し、発光を定量する。
Lentivirus Bioassay is Specific

CAR-19レンチウイルスを導入した細胞に対する応答特異性. TCR/CD3エフェクター細胞をCAR-19またはGFPレンチウイルスの連続希釈液で形質導入した。48時間後、Raji ターゲット細胞(CD19+)を加え、6時間の誘導期間後に発光を検出した。CAR-19レンチウイルスを導入したTCR/CD3エフェクター細胞のみが、Raji ターゲット細胞に対する反応を示した。

抗原ノックアウトにより提示されるアッセイ特異性. TCR/CD3エフェクター細胞をCAR-19 レンチウイルスの連続希釈液で形質導入した。48時間後、Raji ターゲット細胞またはCD19ノックアウトRaji ターゲット細胞を加え、6時間の誘導期間後に発光を検出した。ターゲット細胞に対する反応は抗原ノックアウトにより消失し、このアッセイの特異性が示された。
Lentivirus Bioassay Is Stability Indicating

| Heat Treatment Time (hours) |
EC50 |
% Inhibition of Max |
|---|---|---|
| 0 |
0.81 | Reference |
| 2 |
1.0 |
26% |
| 6 |
2.4 |
18% |
| 24 | 2.5 |
47% |
| 48 | 5.0 |
67% |
Forced degradation samples of CAR-19 lentivirus were prepared by incubating at 37°C for 2–48 hours, then analyzed using TCR/CD3 Effector Cells and Raji Target Cells. The assay demonstrates a loss of lentiviral potency with heat treatment, as measured by an increase in EC50 and a decrease in the maximum response.
T 細胞の代謝
代謝シグネチャーはT細胞機能の重要な決定因子であり、効果的なCAR-T 細胞治療のための貴重な情報です。プロメガの生物発光細胞代謝アッセイは、TCR 改変T細胞や CAR-T 改変 T細胞が代謝要求、酸化還元環境、栄養供給に応答する能力を測定するために使用することができます。これらのプレートベースアッセイは自動化が容易で、ハイスループットのサンプル分析に適しています。

代謝アッセイポートフォリオの概要. これらの生物発光アッセイは、T細胞治療に使用されるドナーT細胞の代謝および酸化ストレス状態を測定する。測定項目:代謝補因子-ATP、NADP、グルコース代謝-グルコース取り込み、乳酸、グリコーゲン、アミノ酸代謝-グルタミン/グルタミン酸、BCAA、脂質代謝-トリグリセリド/グリセロール、コレステロール/コレステロールエステル、脂肪酸酸化、TCAサイクルマーカー-リンゴ酸、イソクエン酸、ピルビン酸。
使いやすく高感度な代謝物アッセイ

NAD(P)H-Glo™ 検出システムの反応模式図. このアッセイは、酵素反応を利用して還元型 NADH および NADPH レベルの濃度を発光測定することにより定量的にモニタリングすることができる、単一の試薬を加えるだけのホモジニアスフォーマットを提供。酸化型であるNAD+とNADP+は検出されず、発光シグナルも妨げません。
CAR-T 細胞の代謝ダイナミクスの測定
CAR-T 細胞の活性化と増殖は、急速なエネルギー生成を促進し、CAR-T細胞の生合成要求をサポートするいくつかの代謝変化を誘導する。特に、CAR-T細胞はグルコースの取り込みと消費量が増加し、乳酸産生も増加。これらの細胞は、効率的なグルコース代謝を可能にする主要な解糖系酵素とトランスポーターの発現の増加も示している。
A.

B.

C.

D.

T細胞の活性化と増殖を通じて変化する培地代謝産物のダイナミクス. (A) 細胞増殖; (B) グルコース消費; (C) グルタミン消費および (D) 乳酸分泌。
T細胞の増殖と拡大
CAR-Tの開発において、T細胞の増殖は治療薬の生成に重要な役割を果たします。この過程で、T細胞は患者の血液から単離され、キメラ抗原受容体を発現するように遺伝子改変が施されます。これらの改変T細胞は次に培養され、IL-2、IL-7、IL-15などの様々な増殖因子で刺激され、増殖と活性化が促進されます。この増殖段階によって、がん細胞を効果的に認識し標的化できるCAR-T細胞の大集団が形成されます。この増殖した CAR-T 細胞集団の生存性を理解することは重要な要素です。プロメガの細胞生存率アッセイシリーズは、代謝活性を有する細胞の指標であるATPを検出・定量することにより、培養中の生存細胞数を決定するためのシンプルで”添加ー混和-測定” だけの簡便でホモジニアスな測定法を提供します。
CAR-T開発のワークフロー例

A.

B.

C.

CellTiter-Glo® 2.0 Assayによる細胞生存性の測定. CellTiter-Glo® 2.0 Assayで測定した発光は、(A) 96ウェルプレート、(B) 384ウェルプレート、(C)1536ウェルプレートにおいて、3桁以上の培養中の生存 Jurkat 細胞数に比例する。
細胞の同一性
CAR-T細胞製造における共通の課題は、患者細胞の同一性と忠実性を保証するためのツールやコントロールが利用できないことでです。ショート・タンデム・リピート(STR)配列は可変でありながら、各ドナーに固有であるため、STRプロファイルは各ドナーのCAR-Tを同定する正確なツールとして利用することができます。GenePrint® 24 System は、マルチプレックスPCRとキャピラリー電気泳動を使用して、正確かつ再現性よく個々のヒトドナーを同定します。
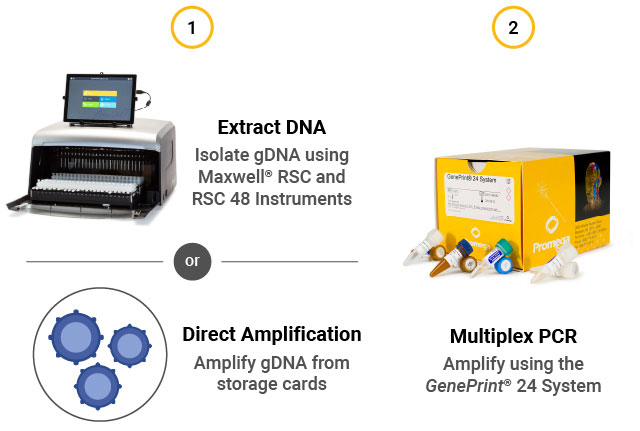

STRアッセイのワークフロー (1) 細胞から gDNAを抽出するか、直接増幅。(2) GenePrint® 24 System を用いてマルチプレックスPCRを実施する。(3) Spectrum Compact CE Systemを用いてキャピラリー電気泳動で断片を検出。(4) GeneMarkerHID® for Spectrum を使用してデータを解析。
GenePrint® 24 System は、以下の用途でSTRに基づくドナーの同定に使用できます:
- CAR-T 細胞製造QC:製造中のCAR-T細胞のユニークなSTRプロファイルをモニタリングし、その同一性を確認。
- 混合検体分析: CAR-T細胞とネイティブ細胞の混合物における同種CAR-T細胞の割合を測定する。

STRプロファイルデータの一致. GenePrint® 24 Systemを用いて直接増幅を行い、Spectrum Compact CE Systemで解析した。その結果、遺伝子組換え CAR-T 細胞とオリジナルドナー細胞間の対立遺伝子の100%一致が確認された。
In Vivo バイオルミネッセンス
バイオルミネッセンスイメージング(BLI)は、動物モデルにおいてCAR-T細胞と腫瘍標的細胞を同時に調べるための優れた技術であり、腫瘍増殖、疾患プロセス、薬効、潜在的な細胞または遺伝子ベースの治療法の評価に対するCAR-T細胞の効果について貴重な洞察を提供します。同一動物内の複数のルシフェラーゼの可視化は、異なるルシフェラーゼ/ルシフェリンの組み合わせを用いることで可能になります。BLIは、これらの相互作用を非侵襲的に追跡・モニタリングできるため、このような研究に特に適しています。BLIを用いることで、研究者はCAR-T細胞が生体という複雑な状況の中でどのように機能するかを包括的に理解することができ、標的がん治療法の開発と改良に重要な情報を提供することができます。
- バイオルミネッセンスは発光に外部光源を必要としないため、蛍光リポーターに比べてバックグラウンドが低く、高感度。
- 同じレポーターツールを in vitro と in vivo の研究に用いることができ、トランスレーショナル・スタディを簡素化可能。
- ホタルルシフェラーゼ(FLuc)と NanoLuc®ルシフェラーゼ(NLuc)は、2つの酵素間で基質特異性が異なるため、理想的なデュアルイメージングソリューションを提供。
- 同一動物内で異なる細胞イベントや異なる細胞集団の追跡が可能
- 基質導入は順次行われるため、最初のシグナルが減少してから2番目のシグナルを読取り。


関連資料
Charles River Laboratories Blog Post:
CAR-T Cell Therapy for Solid Tumors
Webinar:
Resetting Expectations for CAR-T Potency Assessment
Gene Therapy Tools:
Products and technologies to help accelerate gene therapy development