細胞治療のための分子特性解析
DNA配列の検証などの分子特性解析は、細胞治療の開発および製造において極めて重要です。これにより、遺伝子改変の特定、細胞の同定、潜在的な安全性リスクの評価が可能となり、最終的に治療の有効性と安全性が向上します。プロメガは、細胞治療の開発および製造プロセスで広く使用されている、使いやすい核酸抽出および解析ソリューションを幅広く提供しています。
核酸抽出の自動化にご興味がありますか?弊社の自動核酸精製装置Maxwell® Instrumentsの細胞治療分野での活用方法をご確認ください。
細胞に正しいCAR配列が含まれているかを確認する
CAR-T細胞は、腫瘍抗原に特異的なキメラ抗原受容体(CAR)を発現させることで、がん細胞を標的として破壊するように遺伝子操作されたT細胞です。CAR-T製品が正しいCARを発現していることを確認することは、標的効果と患者の安全性を確保するうえで不可欠です。CAR-Tの特性解析および品質管理(QC)アッセイの一環として、CARトランスジーンのコピー数や配列の確認は、qPCRやサンガーシーケンシングによって行われることが一般的です。
プラスミドDNA配列の確認は、CAR-T細胞療法の開発における重要なステップです。当社のプラスミドDNAサンガーシーケンシングワークフローは、治療の完全性を保証し、有効性と安全性の両面を高めることができます。
CAR-T細胞のCAR配列の確認とコピー数の測定の自動化ワークフロー
CAR-T細胞からのDNA精製の自動化
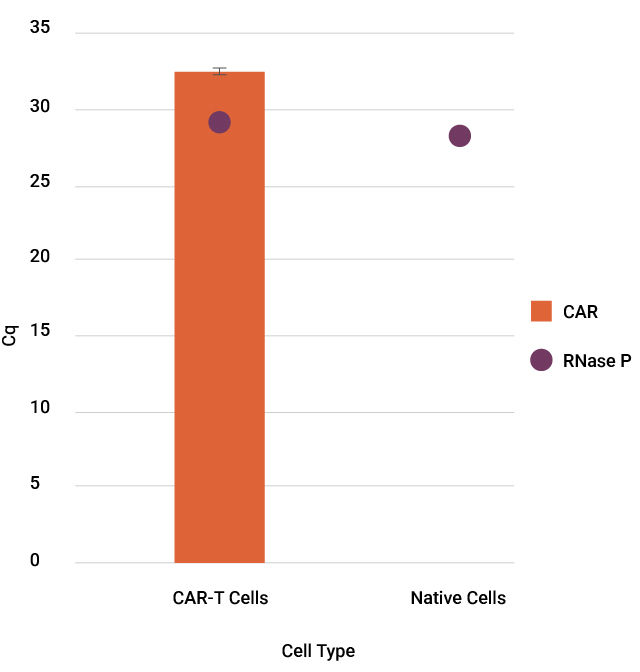
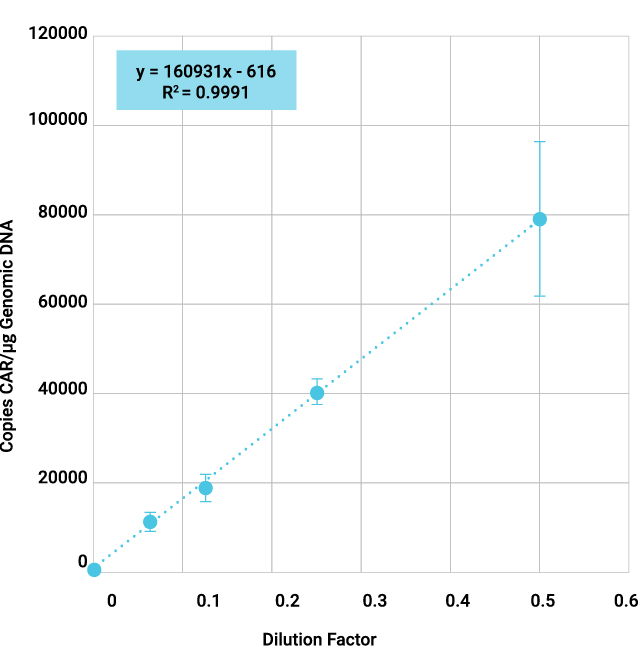
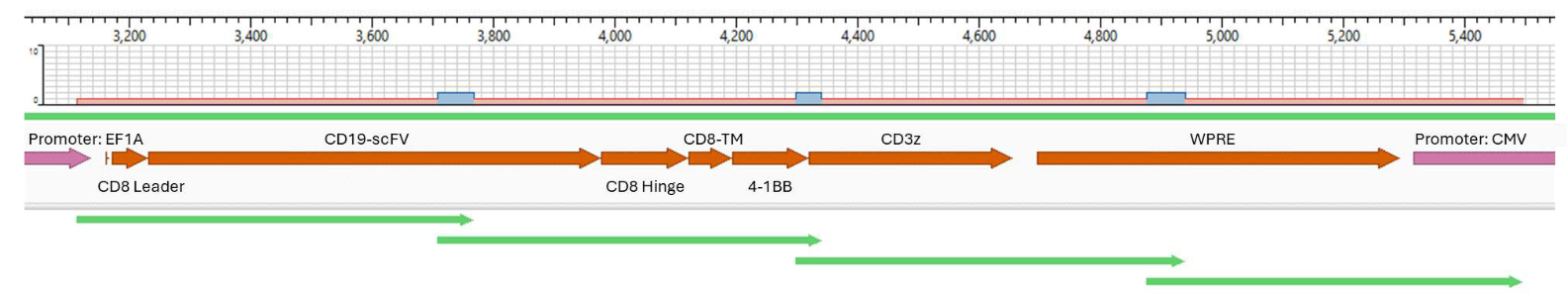
CAR-T細胞でのCARコンストラクトのサンガーシークエンス 50,000個のCD19-CAR-T細胞からDNAを精製しました。ProDye® Terminator Sequencing SystemおよびSpectrum Compact CE Systemを使用して、コンストラクトの4つのオーバーラップするセクションにわたりアンプリコンを精製し、配列を決定しました。アセンブルされたコンティグのマップとコンストラクト全体のカバレッジを示しています。
完全なプロトコルとデータはアプリケーションノートをご確認ください。:Automated DNA Purification from CAR-T Cells
Maxwell®キットおよび機器を用いてDNA/RNAを精製し、分子特性解析を行った代表的な文献を参照:
現在使用中の細胞は親細胞と同じですか?
正しい細胞が使用または製造されていることを確認するために、細胞の同一性検査は極めて重要であり、これは治療の安全性および有効性のいずれにも不可欠です。 ショートタンデムリピート(STR)配列はドナーごとに固有であるため、STRプロファイルは各ドナー細胞の識別に用いることができる正確な手法です。
プロメガのワークフローでは GenePrint® 24 System と Spectrum Compact CE System を使用し、CAR-T細胞の開発および製造に使用される細胞の同一性評価や確認に非常に有効なSTR解析を提供しています。
DNAフィンガープリンティングによるCAR-Tドナー認証のワークフロー
To learn more about CAR-T QC with Sanger sequencing and STR analysis down load our poster.
| Marker | Donor 2006 | Donor 7001 | ||
|---|---|---|---|---|
| T cells | CAR-T | T cells | CAR-T | |
| AMEL | XY | XY | XX | XX |
| D3S1358 | 15 | 15 | 17,18 | 17,18 |
| D1S1656 | 14,16 | 14,16 | 15,17 | 15,17 |
| D2S441 | 10 | 10 | 10,11 | 10,11 |
| D10S1248 | 13,14 | 13,14 | 13,14 | 13,14 |
| D13S317 | 12,14 | 12,14 | 12,13 | 12,13 |
| Penta E | 12,16 | 12,16 | 10,12 | 10,12 |
| D16S539 | 11,12 | 11,12 | 11,12 | 11,12 |
| D18S51 | 12 | 12 | 12,16 | 12,16 |
| D2S1338 | 22,23 | 22,23 | 16,17 | 16,17 |
| CSF1PO | 12 | 12 | 12 | 12 |
| Penta D | 13,14 | 13,14 | 9,13 | 9,13 |
| TH01 | 6,9 | 6,9 | 8 | 8 |
| vWA | 18 | 18 | 16 | 16 |
| D21S11 | 28,32.2 | 28,32.2 | 28,30 | 28,30 |
| D7S820 | 12 | 12 | 8,12 | 8,12 |
| D5S818 | 11 | 11 | 11,13 | 11,13 |
| TPOX | 8,11 | 8,11 | 8,9 | 8,9 |
| DYS391 | 11 | 11 | N/A | N/A |
| D8S1179 | 14,15 | 14,15 | 12 | 12 |
| D12S391 | 17,20 | 17,20 | 17,18 | 17,18 |
| D19S433 | 13 | 13 | 14,16 | 14,16 |
| FGA | 19,26 | 19,26 | 24 | 24 |
| D22S1045 | 15 | 15 | 14,15 | 14,15 |
未刺激T細胞および最終CAR-T製品をFTAカードにスポットし、GenePrint® 24 Systemによる直接増幅を行った後、Spectrum Compact CE Systemで解析した結果、ドナー内でのアレルコールは100%一致しました。
マイコプラズマやその他のコンタミネーションの確認
細胞治療製品におけるマイコプラズマの検出は非常に重要であり、コンタミネーションはこれらの治療法の安全性および有効性を損なう可能性があるため、厳格な規制要件により製品の純度および患者の安全性を確保するための厳密な検査が義務付けられています。
Maxwell® RSC および RSC 48 Instrumentsを用いた自動化ワークフローにより、組織培養細胞および培養上清中のマイコプラズマを10 CFU/mlという低濃度まで精製・検出可能です。
マイコプラズマ検出ワークフロー
細胞培養液または細胞培養上清を分注
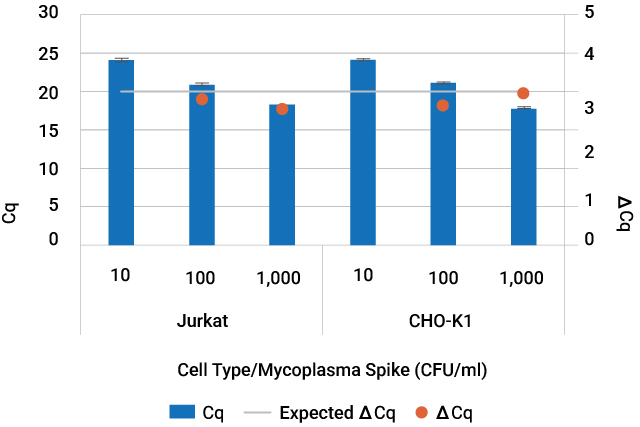
Amplification of mycoplasma DNA purified from contaminated cell culture. Jurkat cell culture and CHO-K1 cell culture supernatant were spiked with 10—1,000CFU/ml of Mycoplasma fermentans. DNA from spiked cell culture and cell culture supernatant was purified with the Maxwell® RSC PureFood GMO and Authentication Kit in technical triplicate. Mycoplasma DNA was detected using the GoTaq® qPCR System.