標的タンパク質分解サービス
分解誘導分子の探索や開発をプロメガの包括的なスクリーニングサービスおよびプロファイリングサービスを利用して加速させましょう。
- 包括的なサービス:最先端の技術を活用して、信頼性の高いデータを取得できます。
- 専門的な連携:お客様と密接に連携し、カスタマイズされた実験計画を設計します。
- 高度なプラットフォーム:標的タンパク質分解に関する豊富な経験を活用します。
- テーラードソリューション:独自の課題にも専門的なサポートで対応します。
- 洞察に満ちた結果:信頼性の高いデータと知見でプロジェクトを前進させます。
新規の分解誘導分子の探索中であっても、既存候補の最適化を目指していても、当社のサービスは必要な成果を提供します。以下でサービスの詳細をご覧いただくか、お気軽にお問い合わせください。
分解化合物プロファイリングサービス
標的タンパク質分解(TPD)は、疾患に関連するタンパク質を除去するために細胞のメカニズムを活用することで、創薬を変革しつつあります。このアプローチは、これまで「創薬不可能」とされてきた標的に取り組む強力な戦略として注目を集めています。しかし、分解誘導化合物を最適化するには、分解効率、選択性、細胞への影響についての正確かつ定量的な知見が必要です。
当社の分解化合物プロファイリングサービスは、分解処理がターゲットタンパク質レベルに与える影響を理解するために必要な重要なデータを提供します。迅速な分解評価による効果測定から、詳細なカイネティクスプロファイリングまで対応可能です。先進的な発光技術であるHiBiT®テクノロジーを用い、エンドポイントおよびリアルタイムのいずれにも対応する高感度なタンパク質分解測定を提供します。新規分解誘導化合物の特性評価、SAR(構造活性相関)の最適化、標的の検証まで、スケーラブルで高品質なデータによって創薬のスピードを加速させます。信頼性が高く、再現性があり、実用的な知見を得るために、ぜひ当社とパートナーシップを結び、TPD研究を前進させてください。

エンドポイント分解プロファイリング
大規模な化合物ライブラリーのスクリーニングに最適です。
- 単一濃度または容量反応により、DC50 および Dmaxを測定
- 複数のタイムポイントで、迅速な分解 (5~6時間)および持続的な分解(18~24時間)を評価
- CellTiter-Glo® assayによる細胞生存率の測定
- 納期:3~5週間(使用する細胞株に応じて)


カイネティック分解プロファイリング
ヒット化合物のカイネティックパラメーターのランク付けに最適です。
- 単一濃度または容量反応を24時間モニタリング
- 分解速度、Dmax、Dmax50を解析し、速度論的な活性を評価
- CellTiter-Glo® assayによるエンドポイントでの細胞生存性試験
- 納期:3~5週間(使用する細胞株に応じて)


Learn more about TPD profiling services:
ネオ基質パネルプロファイリングサービス
現在開発中および臨床段階にある分解誘導化合物の大多数は、E3リガーゼの基質受容体であるCRBNへの低分子結合を利用しています。この結合により、新たなタンパク質間相互作用界面が形成され、さまざまなネオ基質がリクルートされて、それらのユビキチン化と分解が誘導されます。
CRBN結合分子の多くはサリドマイドの誘導体ですが、ネオ基質選択性を決定する化学的・構造的要因は依然として精力的に研究されているテーマです。意図した標的に対して特異性を欠き、重要なネオ基質をオフターゲットで分解してしまうCRBNリクルーティング型のモレキュラーグルーや二機能性PROTACは、臨床応用において安全性上の懸念を生じさせます。
特に、最も一般的に分解される6種類のネオ基質(GSPT1、CK1a、IKZF1、IKZF2、IKZF3、SALL4)は、オフターゲット毒性、好中球減少症や血小板減少症といった血液学的毒性、さらには催奇形性と関連しています。そのため、臨床用分解誘導化合物のプログラムにおいて、これら6種類のネオ基質の分解を早期にスクリーニングすることで、選択性の向上と将来的な安全性リスクの低減が可能となります。
HiBiTは11アミノ酸からなるペプチドタグで、相補的パートナーであるLgBiTと結合することで、機能的なNanoBiT®ルシフェラーゼを形成し、7桁以上の線形ダイナミックレンジを持つ明るい生物発光シグナルを生成します。ネオ基質分解研究では、HiBiTが内在性遺伝子座にゲノム統合されるため、タンパク質量の高感度かつ定量的な検出が発光によって可能となります。分解は、分解誘導化合物による処理から24時間後に評価され、DC50(半最大応答濃度)が算出されます。


HiBiTタグを用いた標的タンパク質分解の検出 標的HiBiT融合タンパク質は、溶液中または細胞内で発現されるLgBiTと相互作用し、発光シグナルを生成します。分解誘導化合物が存在する場合、時間の経過とともに標的タンパク質が分解されることで、発光シグナルは減少します。同様の分解プロファイルは、NanoLuc®融合タンパク質を使用しても得られます。
CRBNベースの分解誘導化合物の選択性プロファイリングのためのネオ基質パネル






モレキュラーグルー分解選択性のためのネオ基質パネル IMiD系モレキュラーグルーに対する6つのネオ基質の標的が、異なる細胞種においてHiBiT CRISPRノックイン細胞株として確立されました:IKZF1およびIKZF2(Jurkat細胞)、IKZF3(MM.1S細胞)、SALL4(SK-N-DZ細胞)、CK1αおよびGSPT1(HEK293細胞)。このネオ基質パネルは、CRBNリクルーティング型PROTACを用いたモレキュラーグルーライブラリーの分解選択性およびオフターゲット効果のスクリーニングを可能にします。スクリーニングに推奨されるエンドポイントは6時間および24時間であり、並行して細胞生存率のカウンタースクリーニングを行います。RLU(相対発光単位)値は、CellTiter-Glo®細胞生存アッセイを用いて正規化されました。
|
Compound |
Primary Neosubstrate(s) |
Indication |
Off-Target Risks |
|---|---|---|---|
|
DKY-709 |
IKZF2 (Helios) |
Solid tumors (immunotherapy) |
Potential off-target degradation of SALL4 and IKZF4 |
|
SJ6986 |
GSPT1, GSPT2 |
Acute leukemia |
Potential off-target degradation of SALL4 or other CRBN substrates, leading to hematological toxicities (e.g., neutropenia, thrombocytopenia) |
|
Thalidomide |
Broad, including IKZF1, IKZF3 |
Multiple myeloma, leprosy, inflammatory diseases |
Teratogenicity (SALL4 degradation), peripheral neuropathy, and hematological toxicities |
|
DEG-77 |
IKZF2 (Helios), CK1α |
Acute myeloid leukemia (preclinical) |
Risk of hematological toxicities (e.g., neutropenia, thrombocytopenia) and possible off-target effects on other CRBN neosubstrates |
|
Iberdomide |
IKZF1 (Ikaros), IKZF3 (Aiolos) |
Multiple myeloma, autoimmune diseases |
Improved specificity reduces risks, but teratogenicity (SALL4 degradation) and hematological toxicity remain concerns |
|
Lenalidomide |
IKZF1, IKZF3 |
Multiple myeloma, myelodysplastic syndrome |
Teratogenicity (SALL4 degradation), hematological toxicities (neutropenia, thrombocytopenia), and thromboembolism risks |
サービス概要
アッセイフォーマット
- 化合物は、10段階の3倍希釈系列で容量反応曲線を作成、プロファイリングされます。
提供されるデータ
- ご提供いただいた化合物の用量反応曲線
- ご提供いただいた化合物のDC50値
- 既知の分解誘導化合物の用量反応曲線およびDC50値
アッセイのタイムポイント
- CellTiter-Glo® 2.0による細胞生存率の測定(6および24時間)
- CellTiter-Glo® 2.0による細胞生存率の測定(24時間)
サービススケジュール
- サービスは月単位で提供
- 納期:2~3週間
透過性およびアフィニティ評価サービス
標的タンパク質分解(TPD)を成功させるには、タンパク質の消失を誘導するだけでなく、細胞内の標的に効率的に到達し、結合することも重要です。透過性は、分解誘導化合物が膜を通過して細胞内標的にアクセスする能力を示し、アフィニティ(親和性)は、E3リガーゼや標的タンパク質などの重要なタンパク質との結合の強さと特異性を示します。これらの特性を最適化することで、分解誘導化合物の効力、選択性、および治療効果が向上します。特に、PROTACのような「ルール・オブ・ファイブ(Ro5)」を超える非従来型分解誘導化合物にとっては極めて重要です。
当社の透過性およびアフィニティ評価サービスでは、分解誘導化合物の設計を洗練し、薬剤様性を向上させるために必要な定量的インサイトを提供します。先進的な細胞ベースのアッセイを用いて、細胞内への到達可能性を予測する透過性の評価と、標的との効率的な結合を実現する親和性の測定を行います。スキャフォールドの設計最適化、SAR(構造活性相関)の評価、候補化合物の比較など、どの段階においても、当社の高品質で再現性の高いデータはTPD研究を加速させます。分解誘導化合物の開発を効率化するために、ぜひ当社との連携をご検討ください。
NanoBRET®ターゲットエンゲージメントおよび細胞透過性評価
- 新規アッセイおよびトレーサーの開発
- 標的タンパク質およびE3リガーゼ(例:CRBN、VHL、XIAP、cIAP、MDM2)に対する分解誘導化合物の結合親和性の評価
- 生細胞および透過処理細胞における分解誘導化合物の透過性の評価
- 納期(プロファイリング):2~3週間


自動化されたVHLターゲットエンゲージメントアッセイによる分解誘導化合物の評価結果
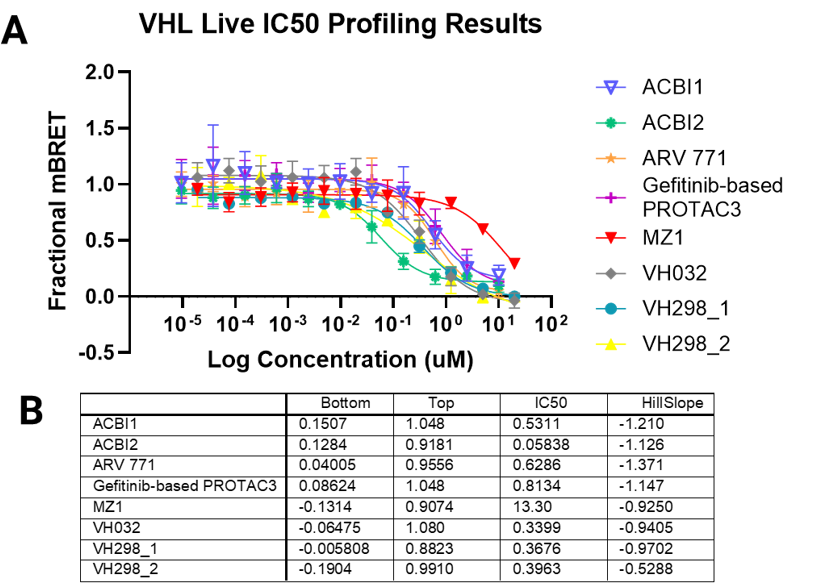
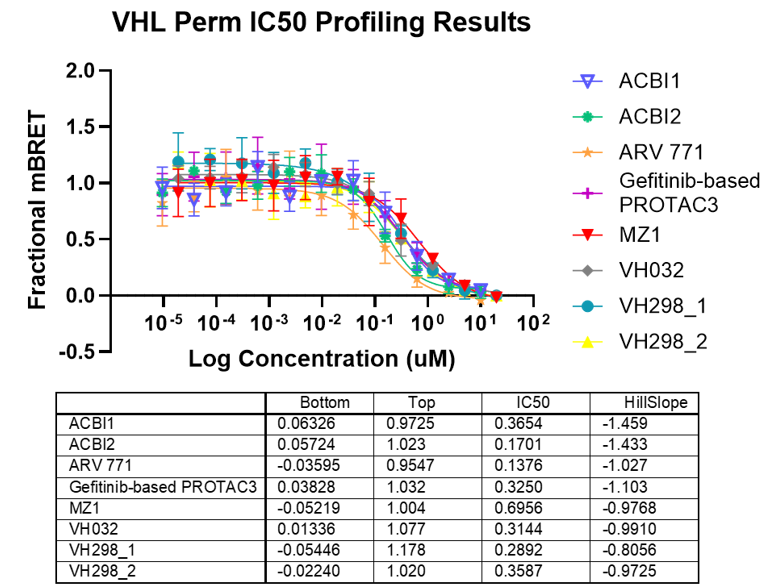
Panel A. NanoBRET®ターゲットエンゲージメント(TE)VHLアッセイにおける、生細胞モードおよび透過処理細胞モードでの化合物濃度反応曲線。VH298は透過性のあるコントロール化合物として使用されました。 Panel B. 非線形回帰曲線から算出された下限・上限の漸近値、IC50、およびヒル係数の値
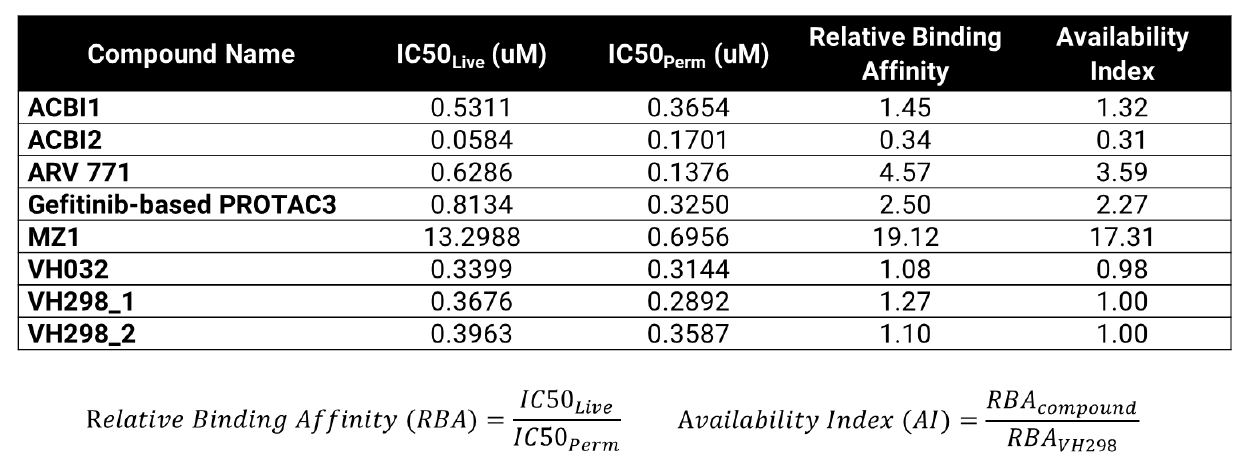
VHLターゲットエンゲージメントアッセイにおける透過性パラメーター
三重複合体形成サービス
三重複合体の形成(分解誘導化合物、標的タンパク質、E3リガーゼを含む)は、タンパク質の除去を促進する上で重要なステップです。この複合体の安定性や動態は、分解誘導化合物の効力、選択性、細胞内での有効性に直接影響を与えます。分解誘導化合物がどれほど効率的に三者複合体を形成するか、そしてその相互作用がどれくらい持続するかを理解することは、分解機能を最適化し、リード化合物を前進させるために不可欠です。
プロメガの三重複合体形成サービスでは、高感度なNanoBRET®テクノロジーを用いて、分解誘導化合物による相互作用を定量的かつリアルタイムに解析します。生細胞内での複合体形成を正確に測定するアッセイにより、分解誘導化合物の設計を洗練させることが可能です。化合物の優先順位付け、SAR(構造活性相関)の最適化、作用機序の解明など、あらゆる段階で弊社のサービスは信頼性が高く高品質なデータを提供し、TPD研究の加速を支援します。治療革新を推進するために、ぜひ弊社をパートナーとしてお選びください。
NanoBRET®三重複合体形成アッセイ
- 新規アッセイの開発および試験
- エンドポイント形式またはカイネティクス形式による分解誘導化合物のプロファイリング
- 単一濃度または用量反応での評価
- 納期(プロファイリング):3~4週間

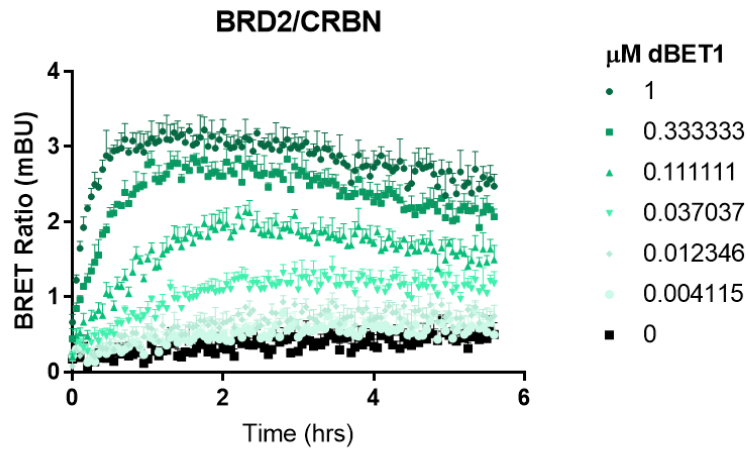
一過性NanoBRET®アッセイによるネオサブストレート三重複合体形成のスクリーニング


一般的なネオサブストレートおよびCRBNに対するNanoBRET®三重複合体アッセイの最適化 NanoLuc®ネオサブストレートおよびHaloTag® CRBN融合タンパク質は、プロテアーゼ阻害剤MG132の有無にかかわらずHEK293細胞で発現されました。全てのN末端およびC末端の融合構成について、1:10および1:100の比率で試験が行われました。結果として、モレキュラーグルー添加により三重複合体が形成され、BRETシグナルが有意に増加することが示されました。
ユビキチン化評価サービス
標的タンパク質のユビキチン化は、プロテアソームによる認識と分解のための重要なステップです。ユビキチン化が不十分または不完全であると、分解誘導化合物の効果が制限される可能性があるため、その程度、速度論、選択性を明らかにすることが重要です。このプロセスを理解することで、分解誘導化合物の作用機序に関する重要な知見が得られ、効力と選択性を高めるための化合物設計の最適化に役立ちます。
プロメガのユビキチン化評価サービスは、先進的なNanoBRET®技術を用いて、生細胞内での標的ユビキチン化のリアルタイムかつ定量的な測定を可能にします。これらのアッセイはユビキチン化の効率を正確に評価し、研究者が分解誘導化合物の性能を評価し、SAR(構造活性相関)の最適化や化合物選定の精緻化を行うのに役立ちます。分解誘導化合物の比較、E3リガーゼの特異性の検討、効力の微調整など、あらゆる段階において、プロメガのサービスは高品質で再現性の高いデータを提供し、TPD研究の加速を支援します。ユビキチン化動態の重要な知見と次世代分解誘導化合物の開発を進めるために、ぜひ弊社をパートナーとしてお選びください。
NanoBRET® 標的ユビキチン化アッセイ
- 新規アッセイの開発および試験
- エンドポイント形式またはカイネティック形式による分解誘導化合物のプロファイリング
- 単一濃度または用量反応での評価
- 納期(プロファイリング):3〜4週間

