免疫原性細胞死:ダメージ関連分子パターン(DAMPS)を測定する方法
By Andrew Niles and Kevin Kupcho
Abstract
細胞死の研究は、過去50年間で多くの興味深い変化を遂げてきました。細胞が死ぬメカニズムが、生体内のシステムに大きな影響を与えることは、今や誰もが認めるところです。そのような状況において、免疫原性細胞死(ICD)は、それが自然免疫および適応免疫の各応答にどのように影響するかについて、最近新たな知見が得られてきています。 ダメージ関連分子パターン(DAMP)は、
ICD中に生成される特定の生体分子メッセンジャーであり、このプロセスの進行と規模に関与します。 したがって、それらの存在を積極的に調整することは、健康と病気の両方に重要な影響を及ぼします。
DAMPを定量化するための従来のアッセイ法は、妥当な情報価値を提供しますが、その実施には手間と時間がかかる可能性があります。 ここでは、完全にホモジニアスで標準的な発光測定プラットフォームで使用できる2つの新しい生物発光アッセイ (RealTime-Glo™ Extracellular ATP Assay と Lumit™ HMGB1 Immunoassay) について説明します。 同時に、これらの信頼性が高く堅牢なアッセイは、in vitroにおける免疫原性細胞死応答を操作するための実験戦略を評価するのに便利なワークフローを提供します。
Introduction
多細胞ホメオスタシスは、十分に組織化され、プログラムされた細胞死メカニズムのまとまりによって部分的に維持されています。 これらのプログラムは、一般的に「寛容原性」または「免疫原性」モードのいずれかに分類されます。 寛容原性の形態 (免疫学的にサイレントな アポトーシス)としても知られている)は、カスパーゼの活性化と細胞膜の非対称脂質リモデリングにつながる、確立された内因性または外因性のシグナル伝達カスケードを伴います。 内膜表面から外膜表面への重要なホスファチジルセリン転座イベントは、膜の完全性が失われる前に死にかけている細胞が貪食されるために必要な「eat me !(私を食べて!)」信号を提供します。 この形態の細胞死は炎症を促進せず、一般に、発生および組織リモデリングプロセス中で老化、損傷、冗長化あるいは不要となった免疫細胞の除去、または他の細胞型の効率的な除去に関連しています。
免疫原性細胞死として知られる炎症性の実施形態は、ネクロトーシス、ピロトーシス、フェロトーシス、NETosis、または異なる形態のアポトーシスなどのサブルーチンにさらに分離することができます。 特定のサブルーチンに関係なく、DAMPは細胞外環境に曝露および/または放出され、免疫細胞の浸潤とそれに続く局所的な炎症を持続させます。ICDは、ウイルスや細菌の攻撃や、腫瘍特異的細胞傷害性T細胞の後天性発達のための重要な第一線の防御手段です。ICDはまた、急性および慢性の両方の病状を引き起こすために阻害される可能性があります。
細胞外アデノシン三リン酸(eATP)と高移動度グループボックスB1(HMGB1)タンパク質は、免疫原性細胞死の表現型を規定するために重要であると見なされている2つのDAMPです。 ATPは主に普遍的なエネルギー輸送分子として知られていますが、その細胞外形態は多様な細胞間シグナル伝達イベントに関与することが知られています。 eATPは、多種多様な細胞タイプで発現するP2プリン作動性受容体を介してこれらの効果を仲介します。 ICDの場合、死にかけている細胞に由来するeATPは、樹状細胞(抗原処理細胞)へ初期化学誘引物質勾配を提供し、応答する免疫細胞からのパラクリン放出によって炎症イベントを維持します。
HMGB1は、主要なクロマチン関連の非ヒストンタンパク質で、核内に局在します。 ICDイベント中に、HMGB1は細胞質に移動し、最終的には、未知のチャネル活性化イベントによって、または死後の膜の完全性の喪失後の受動的放出によって、細胞外環境に放出されます。 細胞外HMGB1は、樹状細胞の成熟と炎症性イベントの全体的な悪化を促進するさまざまな酸化還元状態で存在します。
各バイオマーカー単独でも免疫原性細胞死イベントの程度を評価するための予測値を提供しますが、eATPとHMGB1を組み合わせることで、単一のパラメーター測定よりも表現型について統計的に有意な指標を提示します。 したがって、両方のバイオマーカーを迅速かつ容易に測定する機能は、ICDの変調に関連する発見および開発活動の鍵となります。
免疫原性細胞死を測定する従来の方法
免疫原性細胞死を測定する従来の方法
eATPとHMGB1は、ICDイベント中に時間依存的に細胞外環境に放出されます。 現在の方法では、細胞上清サンプルを定期的に収集し、一定量の培地を除去し、それを低速遠心分離にかけて細胞および/または細胞破片を除去する作業が、タイムコースにわたって行われます。 次に、特定の分析物のレベルを調べるまで、上澄みを通常+4または-20°Cに置きます。 上澄みを再現性よく収集して処理したり、細胞や破片を除去したり、適切に保管したりしないと、eATPとHMGB1の定量を複雑にする可能性があります。
細胞外ATPは、最も一般的な方法としてエンドポイント発光測定によって定量されます。 この方法では、過剰なルシフェラーゼとルシフェリンを含む反応混合物を、未知のレベルのeATPを含むサンプルと混和します。生物発光反応は、サンプル内のeATPに比例する光の光子を生成します。 ただし、上清からeATPを正確に測定する場合、特に大きな課題が存在します。 たとえば、ほとんどの形質転換細胞株は、細胞膜に存在するATPase(CD39など)の発現が増強され、それが増殖しており、さらに血清中にはかなりのATPase活性も存在しています。 これらのエクトピラーゼ活性は、数分以内にeATPレベルを劇的に低下させるため、サンプリングおよび処理中に実験的に放出されたeATPの濃度測定を困難にします(図1)。
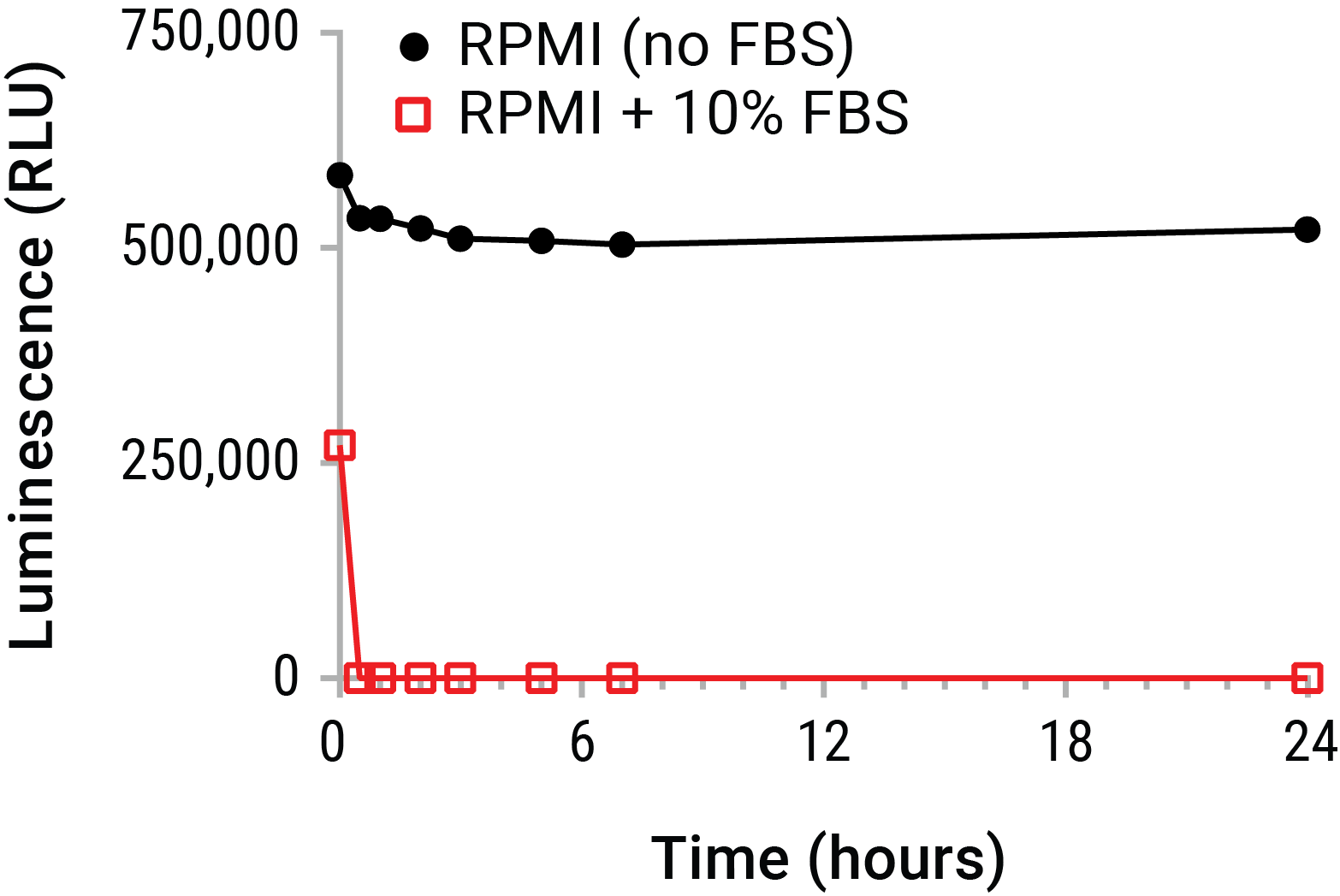
図1. 細胞培養環境における細胞外ATPの不安定性 精製ATP(20nM)を10%FBSの有無にかかわらずRPMI 1640にスパイクし、氷上に置きました。 サンプルを定期的に取り出し、24時間のタイムコースにわたって37℃でインキュベートした。 CellTiter-Glo® Luminescent Cell Viability Assayを使用して、タイムコース上のすべてのサンプルからATPを測定した。 標準的な上清収集方法においては、短期間でかなりのeATP減衰のリスクがあることをデータは強く示した。 アッセイ前のこの減衰は、eATPレベルを大幅に過小評価する可能性がある。 したがって、減衰前のeATPのリアルタイム測定が望ましいことが示唆された。
HMGB1レベルは、通常、ウエスタンブロットまたはELISAによって測定されます。 ウエスタン分析は分析対象物放出の重要な生化学的証拠を提供しますが、それは定量性に乏しく、面倒で、手間を要します。 ELISAも面倒で時間がかかりますが、非常に高い感度を提供します。 しかし残念なことにELISAフォーマットもダイナミックレンジが悪いという問題があります。 この限られたダイナミックレンジでは、アッセイの直線性範囲内に収まるように、テスト前にサンプルを希釈する必要があります。 サンプルの分析対象物レベルが不明な場合は、サンプルをきちんとさまざまな希釈レベルで分析するために、処理するサンプルの数を増やす必要があります。 さらに、十分に検証された市販のアッセイはコストが非常に高くつく可能性があります。
細胞外ATPおよびHMGB1を測定するための改善された方法
プロメガはサンプルの回収と処理を必要としない2つの新しいホモジニアスなアッセイケミストリーを開発することにより、ICD分析ワークフローを大幅に合理化しました。 それぞれの試薬を調製して、並行する実験サンプル培養ウェルに入れるだけです。RealTime-Glo™ Extracellular ATP Assay 試薬には、生細胞測定用に処方された、熱安定性のUltra-Glo®ルシフェラーゼと化学的に純粋なルシフェリンが含まれています(図2)。これらの成分を培養培地と混合し、時間「0」で処理細胞と未処理細胞に添加して、経過時間ごとにeATP放出を検出します。(図3)。これらの反応物は、リアルタイム測定用に最適化されているため、未処理の細胞への影響を最小限に抑えながら、eATP放出のベースラインを確立できます。 新しいフォーマットによって提供されるかなりの時間と労力の節約に加えて、リアルタイムの読み出しは、曝露中のeATPレベルの継続的かつ同時的なレポートを提供します。 環境ガス制御またはCO2 非依存性培地のいずれかを使用することで、カイネティックモードで温調付きルミノメーターを使用する自動フォーマットは最終的な曝露時点まで完全な手間なし(ハンドオフ)アッセイを実現できます(図4)。

図2. 生物発光細胞外ATP検出ケミストリー

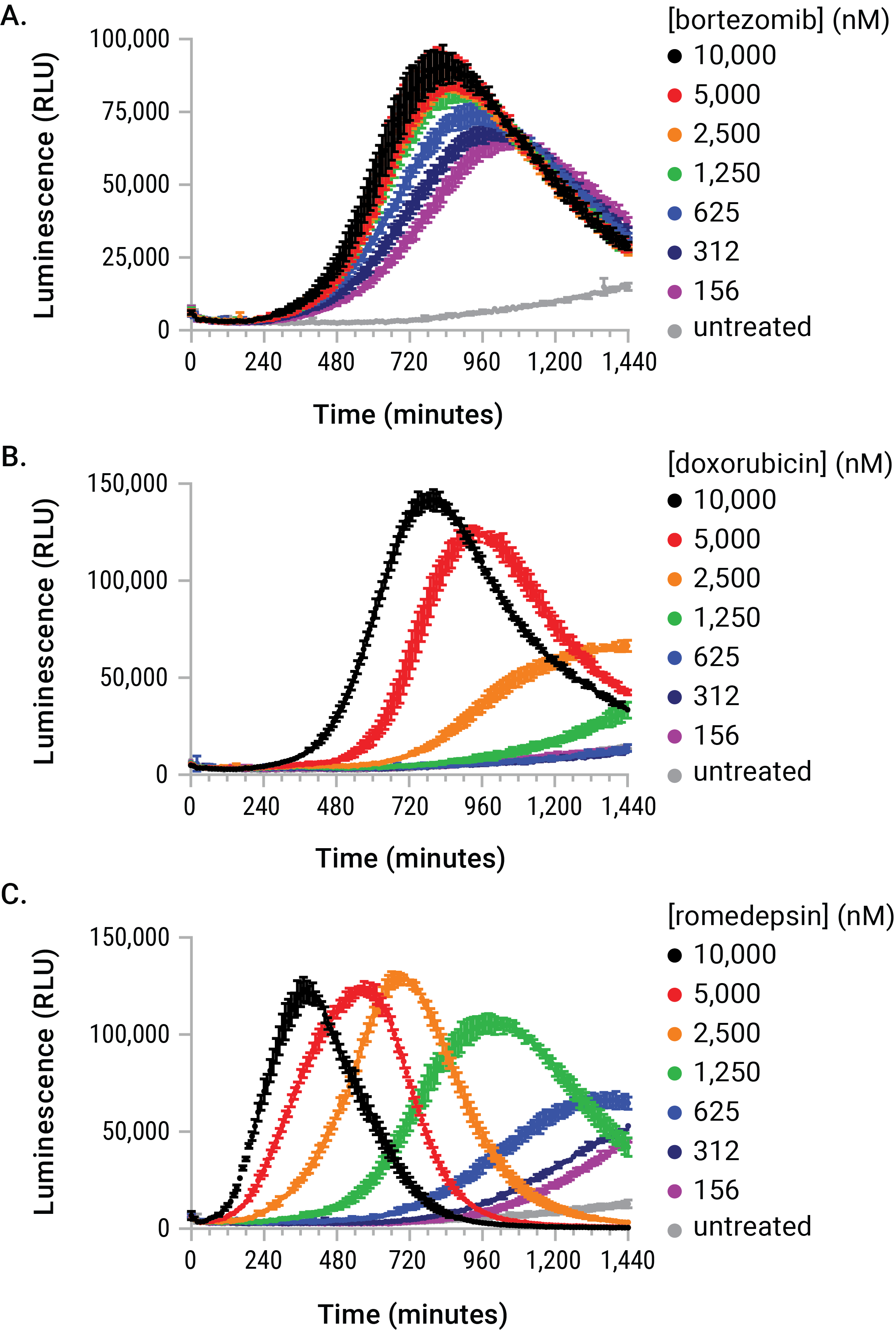
図4. 用量と時間に依存する刺激によるeATP放出
U937細胞には、RealTime-Glo™ Extracellular ATP Assay試薬の存在下で、ボルテゾミブ、ドキソルビシン、およびロミデプシンの段階希釈液を投与した。 曝露中に生成されたeATP放出プロファイルは、投与量、時間、およびシグナルの大きさに関して速度論的に固有のパターンを示した。 これらの違いは、これまで行われてきたエンドポイントでのeATP測定法では解釈を困難にし、不正確になる可能性を示唆した。
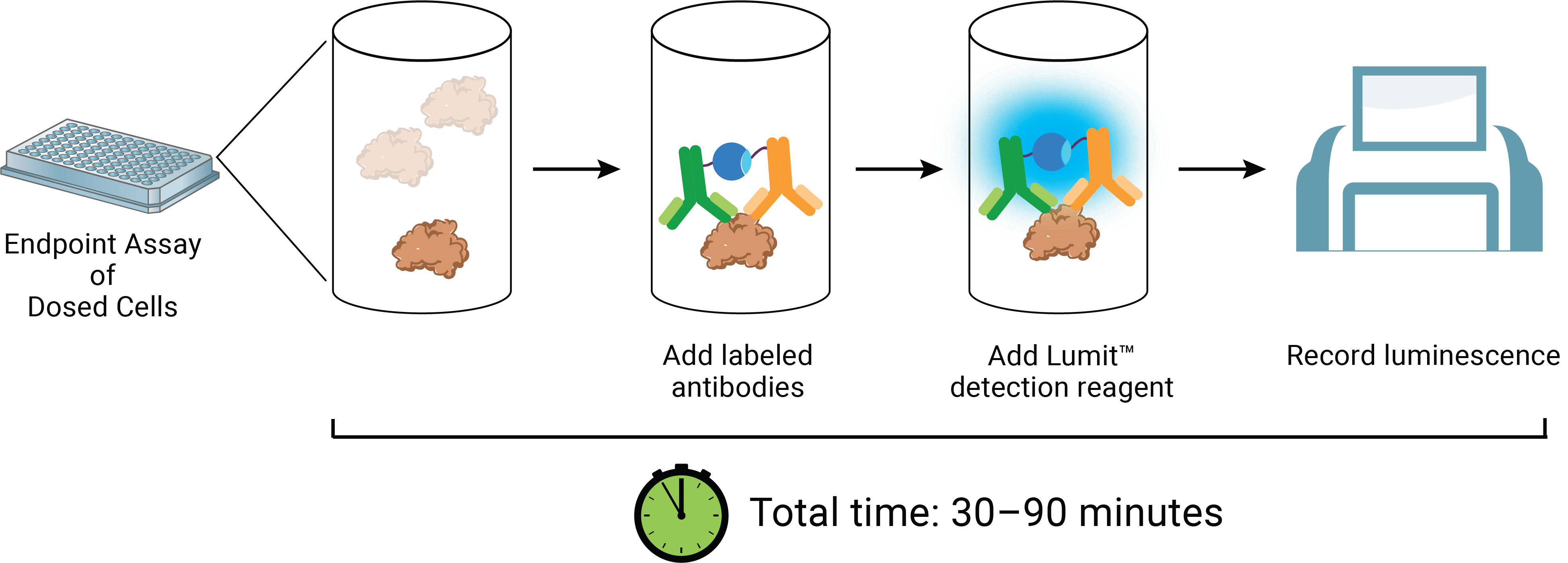
Lumit™ HMGB1 Immunoassay 試薬は、曝露完了時にテストウェルに直接添加できます。 この試薬には、ルシフェラーゼ基質と、相補的な分割ルシフェラーゼ断片(LgBiTまたはSmBiT)が結合した2つの抗HMGB1モノクローナル抗体が含まれています(図5)。
HMGB1分析物がない場合、この標識抗体は溶液中で遊離および非結合のままであり、わずかな発光シグナルのみを生成します。 HMGB1の存在下で、抗体はそれらの関連するエピトープに結合しすることでLgBiTおよびSmBiTが近接することで相補性を促進します。 これらのイベントの結果、分析物の量に比例する発光が生じます。 したがって、化合物のICD誘導特性は、時間に対する応答の効力と大きさを追跡することで説明できます(図6)。
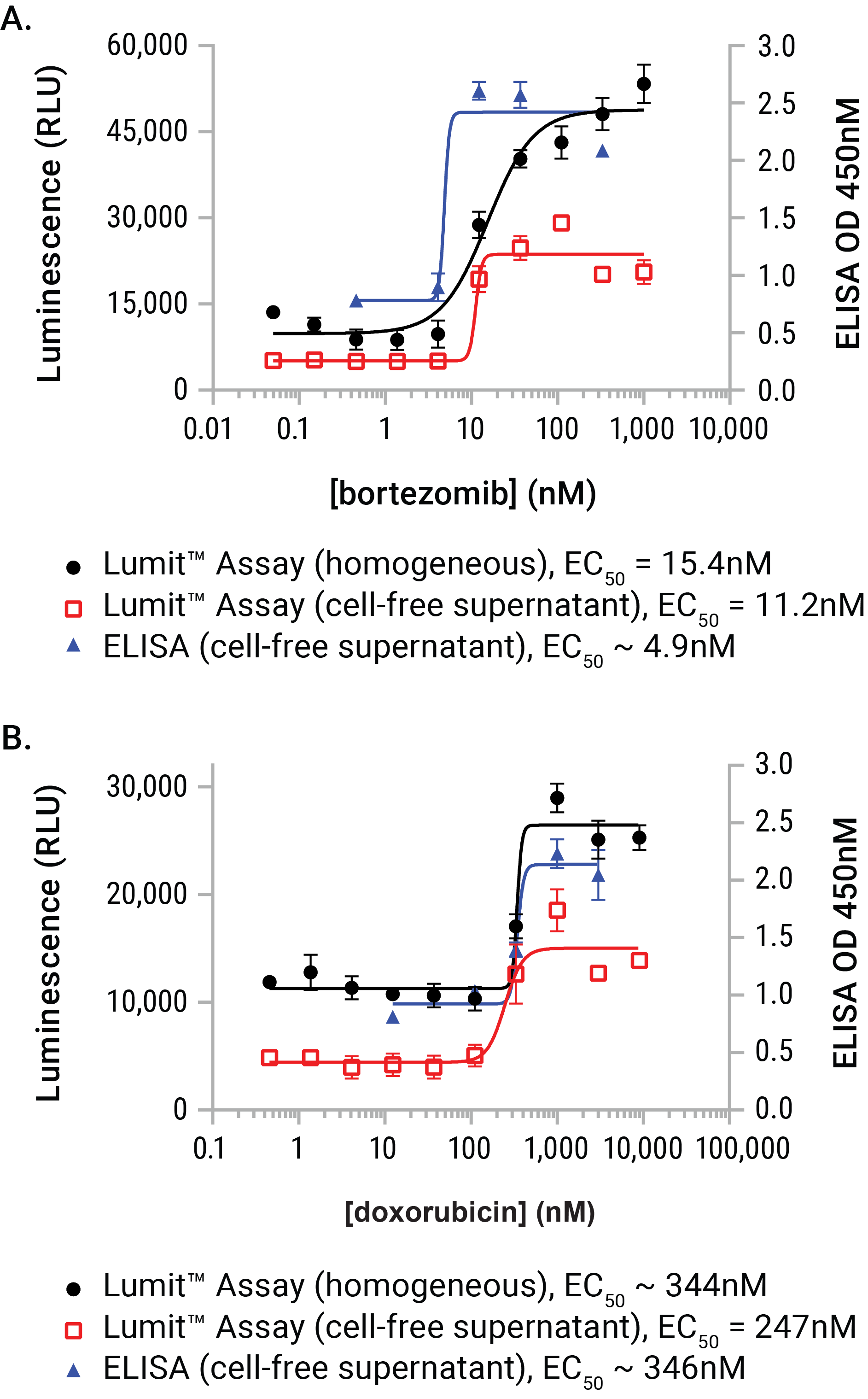
特に、ICD誘発性放出イベント後のHMGB1抗原検出は、Lumit™法を用いることでそのままの細胞サンプルまたは上清のいずれかを用いて測定することができます。 どちらのサンプルタイプも、既存のELISA法とよく相関しています(図7)。 さらに、実験から得られた誘導値と非誘導値は、キットで提供される組換えヒトHMGB1の標準曲線と比較することができます。 追加の実験により、HMGB1のマウスアイソフォームとの有意な交差反応性が実証され、同様の誘導システムでの分析が可能になりました。
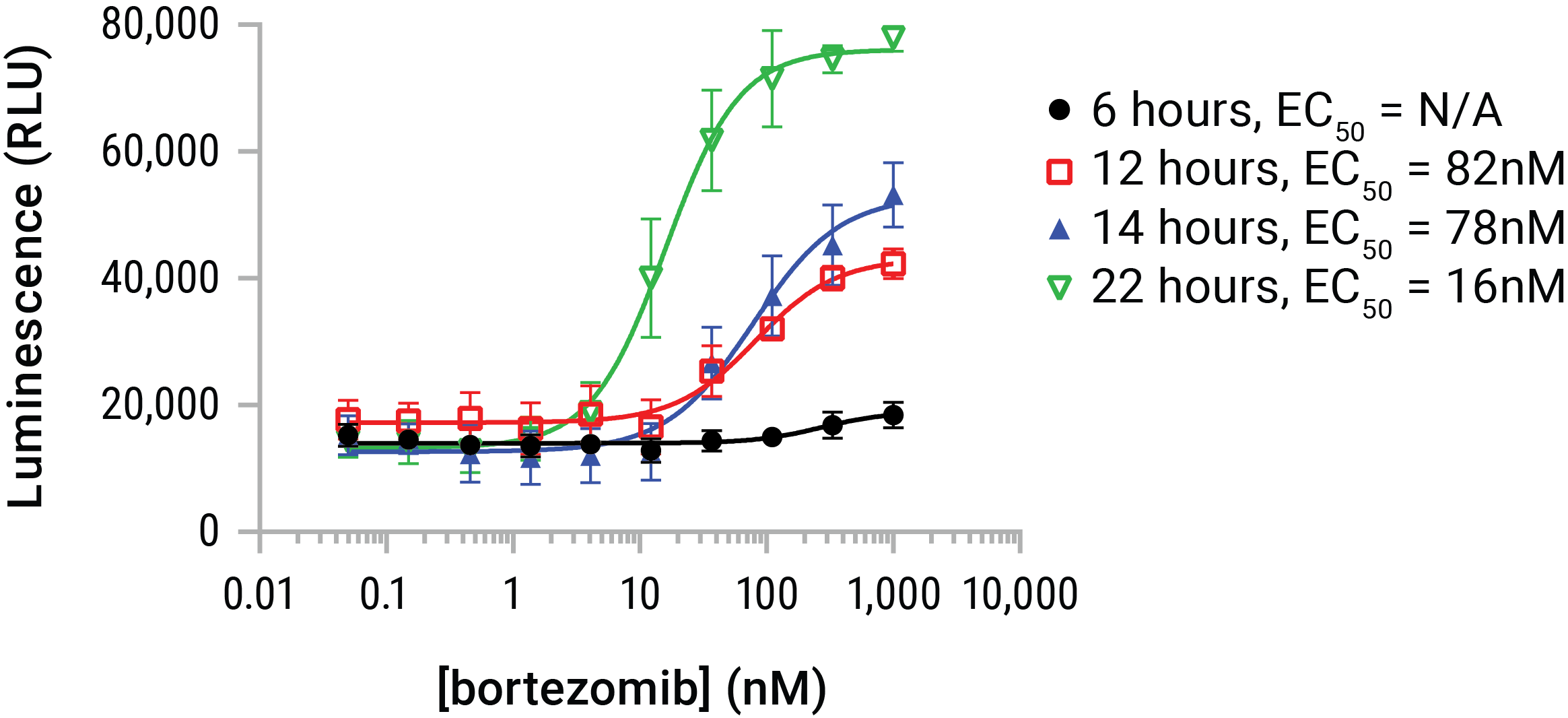
U937細胞にはボルテゾミブの段階希釈が投与され、6、12、14、および22時間暴露されました。 Lumit™ HMGB1 Immunoassay試薬をエンドポイントに添加し、発光データを収集しました。 ボルテゾミブ添加によるHMGB1の放出は約6時間後に始まり、22時間後まで継続されました。 このモデルでは、HMGB1の放出は時間とともに増加しましたが、HMGB1自体は、長時間の曝露で抗原性が失われる傾向があるため、24時間および48時間の暴露は、通常、潜在的または効力が不明な化合物で使用することが推奨される。
ICDツール化合物とモデル細胞株を使用したメソッドバリデーション
RealTime-Glo® Extracellular ATP Assay and Lumit™ HMGB1 Immunoassay は、in vitro ICDの発見および特性評価の取り組み中で使用するために設計されました。 したがって、DAMP誘導ツール化合物の段階希釈を投与したさまざまなヒト(図8)およびマウス(図9)の浮遊細胞および付着細胞を使用してアッセイを検証しました。 ATP放出実験のデータは、大気制御を備えたBMG CLARIOstar™またはCO2非依存性培地を使用したCLARIOstar™のいずれかを使用してリアルタイムで収集されました。 リアルタイムのeATPデータとLumit™ HMGB1データは、 GloMax® Discover を使用して収集されました。

図8.ヒト細胞株を用いたデュアルDAMP測定 U937細胞を含む2枚のプレートにミトキサントロンの段階希釈液を投与した。 1つのプレートにはRealTime-Glo™ Extracellular ATP Assay試薬を10%FBS含有CO2非依存性培地投与時に追加し、GloMax® Discoverを使用して24時間にわたりシグナルを収集した。 2番目のプレートは24時間インキュベートした後、Lumit™ HMGB1 Immunoassay 試薬を直接添加した後、GloMax™ Discoverを使用して発光を測定した。トップパネル: ミトキサントロンは、用量および時間に依存したeATPの放出をもたらし、これは時間経過とともに効力の漸進的な増加をもたらした。 下のパネル:組換えヒトHMGB1抗原では、1ngから729ng/mlまで直線性応答が得られた。 ミトキサントロンは、eATPと一致する効力で用量依存的なHMGB1放出イベントを誘発した。

図9. マウス細胞株でのデュアルDAMP測定
2枚のプレートで培養したEL4細胞には、イダルビシンの段階希釈液を投与した。 1つのプレートにはRealTime-Glo™ Extracellular ATP Assay試薬を10%HSを含むCO2非依存性培地投与時に添加し、24時間の暴露後にGloMax® Discoverを使用してシグナルを収集した。 2番目のプレートは24時間インキュベート後にLumit™ HMGB1 Immunoassay試薬と直接添加した。 GloMax™ Discoverを使用して発光を測定しました。 トップパネル:イダルビシンは、用量および時間に依存したeATPの放出をもたらしましたが、これは、期間中の効力のわずかな増加のみをもたらしました。 下のパネル:組換えマウスHMGB1抗原は、3ngから2,187ng/mlの直線性応答が得られました。 イダルビシンは、eATPよりも実質的に強力な用量依存的なHMGB1放出イベントを誘発しました。

