細胞治療のための細胞の健康状態と代謝研究ソリューション
細胞治療において、細胞の健康状態および代謝をモニタリングすることは非常に重要です。これらは最終的な細胞製品の有効性、安全性、そして治療全体の可能性に直接影響を与えるためです。当社の多様な高感度の「加えるだけで読み取れる」アッセイ群は、細胞の生存率、増殖、代謝に関する疑問に答える手助けをします。
このポスターでは、幹細胞メモリ表現型を富化するために最適化されたT細胞活性化プロトコルについてご紹介しています。
細胞は生存している?
CellTiter-Glo® Luminescent Assays は、ATPの定量に基づいて細胞の生存率を測定します。ATPは代謝的に活性な細胞の存在を示します。これらのアッセイは、「添加・混和・測定」というホモジニアスフォーマットで実施できるため、特に MyGlo™ Reagent Reader や GloMax® Microplate Readers と組み合わせた場合に、迅速かつ簡便なワークフローが可能です。このアッセイは、単層細胞培養、3Dマイクロティッシュ、オルガノイド、初代細胞、幹細胞など、さまざまなモデルシステムやサンプルタイプにおける細胞生存率の評価に使用されます。
プロメガの細胞生存率アッセイの細胞治療の開発における引用文献
細胞は増殖している?
簡便な「添加・混和・測定」プレートフォーマットの Lumit® hKi-67 Immunoassay は、一般的な増殖マーカーであるKi-67を用いて細胞の増殖を測定します。このアッセイは、他の一般的な手法に見られる、煩雑な洗浄工程、代謝活性が増殖を誤って示す可能性、特殊な機器の必要性といった課題を克服します。作業負担と準備時間の削減、より迅速な意思決定、そしてデータへの信頼性向上に貢献します。


80,000細胞/ウェルで播種されたヒトCD8+ T細胞(StemCell Tech製)に対し、10ng/mlのIL-2を添加した(オレンジ)場合と添加しない(ブルー)場合のCD3/CD28 T細胞活性化剤による処理を48時間行いました。T細胞の増殖(活性化後72時間以降に開始)よりも前に、Lumit® hKi-67 Immunoassay によりKi-67の発現上昇が確認され、増殖の早期指標として本アッセイを使用できることが示されています。
細胞の代謝は健全ですか?
細胞代謝は、細胞治療の開発および製造において極めて重要です。なぜなら、代謝は細胞の成長、分化、機能に影響を与え、これらは高品質で治療効果の高い細胞を生産するために不可欠だからです。代謝経路の理解と最適化は、細胞の収量、生存率、治療効果を高め、細胞治療の成功と大規模化を可能にします。当社では、グルコース取り込み、乳酸、グルタミン、酸化ストレス、NAD(P)Hなどの代謝活性を測定するための高感度な「加えるだけで読み取れる」バイオルミネセンスアッセイを幅広く提供しています。
細胞の代謝状態は、以下の方法で評価できます:
- 培養培地中の代謝物の変化をモニタリングする
- 細胞内の主要な代謝補酵素(NAD(P)/NAD(P)H)および代謝物をプロファイリングする
- 主要な代謝経路の調節因子である脱水素酵素の活性を測定する

反応の模式図(NAD(P)H-Glo™ Detection System での一例) このアッセイは、バイオルミネセンスを利用した均一型のワンステップアッセイであり、酵素反応中の還元型補酵素であるNADHおよびNADPHの濃度を定量的にモニタリングします。酸化型であるNAD⁺およびNADP⁺は検出されず、発光シグナルに干渉しません。
T細胞における代謝のモニタリング
幹細胞様記憶表現型(Tscm)を有するT細胞は、他のタイプと比較して、in vivoでの持続性と機能が高いことが知られています。Tscm細胞の産生は、CAR-Tなどの免疫療法において大きな可能性を秘めています。細胞の健康状態や代謝アッセイを用いて培養条件を最適化・モニタリングすることで、Tscm細胞の増加を予測する指標を特定し、より多くのTscm細胞を得ることが可能になります。さらに、代謝測定はT細胞の表現型プロファイルを早期に予測する指標としても機能します。
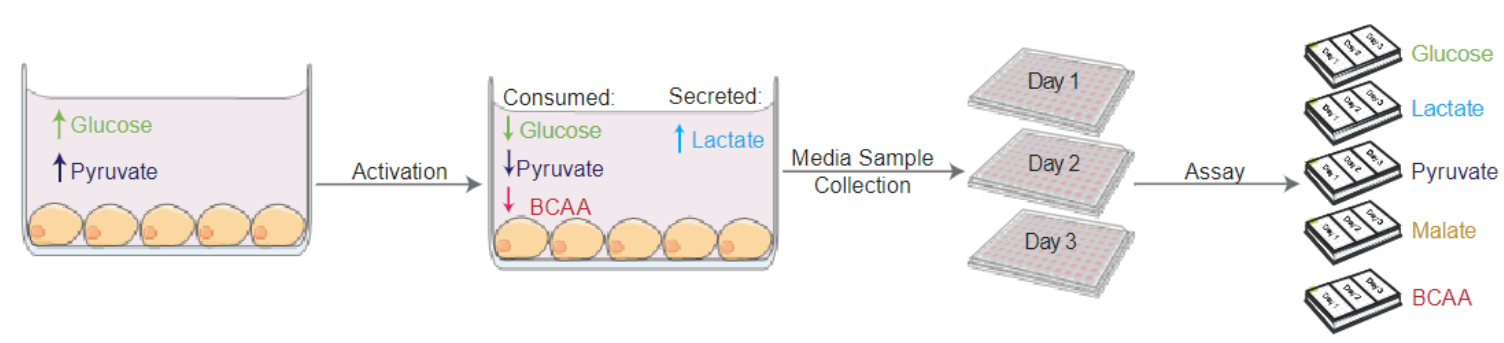
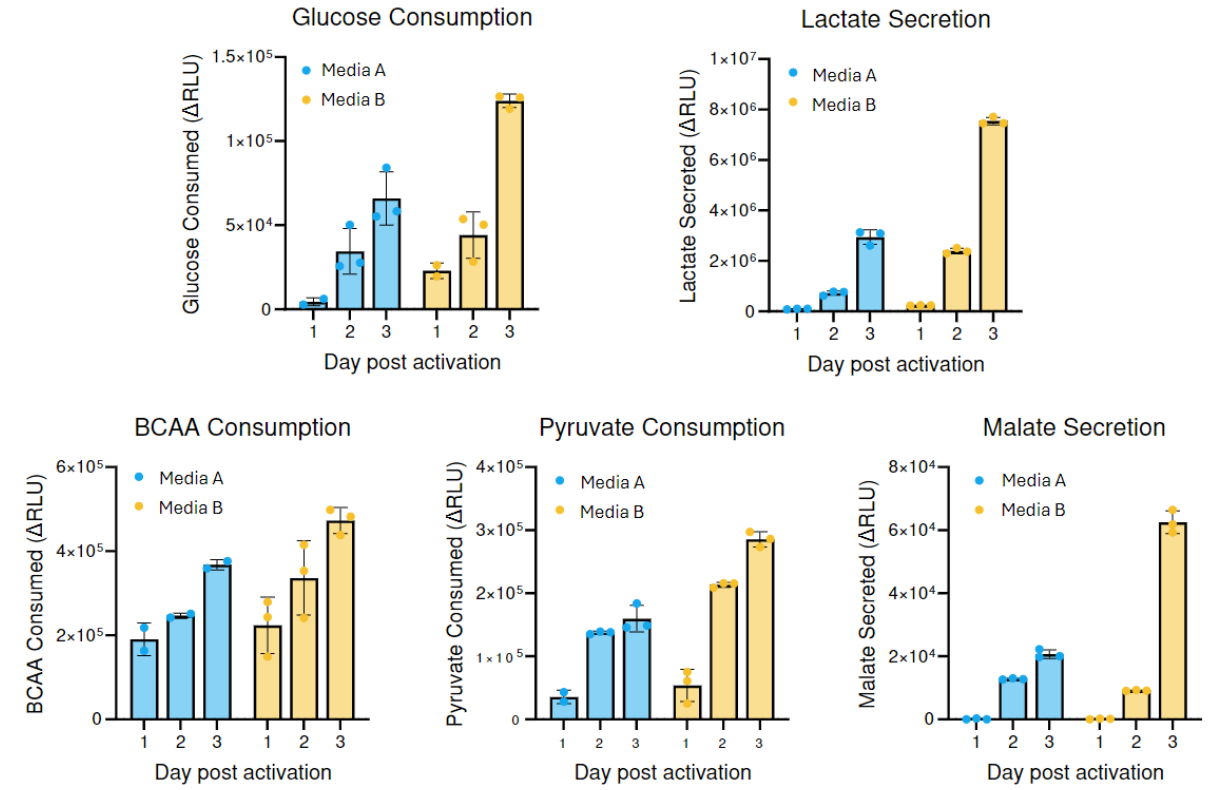
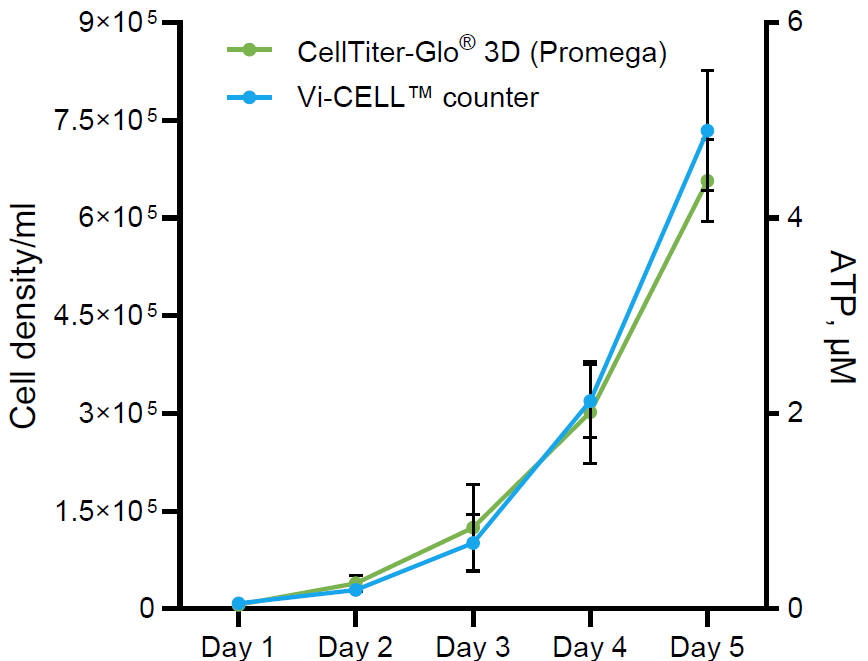
活性化T細胞の代謝プロファイルは培養条件に大きく依存します。詳細はこちらのポスターをご確認ください。:Optimization of T Cell Activation Protocols to Enrich Stem Cell Memory Phenotypes
T細胞の代謝モニタリングについてのおすすめ資料:
ポスター
幹細胞様記憶表現型を増強するためのT細胞活性化プロトコルの最適化
代謝測定を用いて、増殖したT細胞の表現型プロファイルを予測するための早期スクリーニングとして活用する方法をご紹介します。
論文
CAR-T細胞製造のための代謝プライミング
プロメガの代謝物検出アッセイが、CAR-T細胞製造における持続性、効果、記憶形成を高めるために、培地および増殖条件の最適化にどのように活用されたかをご紹介します。
ポスター
細胞治療製品における代謝プロファイリングのためのシンプルな細胞ベースアッセイ
プロメガの生物発光を利用した代謝物測定アッセイが、T細胞活性化中の代謝変化のプロファイリングにどのように活用できるかをご紹介します。
hMSC増殖のための代謝モニタリング
ヒト間葉系幹細胞(hMSC)療法の成功は、体内で機能するのに適した代謝的に健全な細胞を増殖させることにかかっています。増殖中のグルコース消費や乳酸産生といった栄養素のモニタリング、酸化的リン酸化、細胞内グルタミンおよびグルタミン酸のレベルを監視することは、一貫性があり均一な細胞増殖のために重要です。
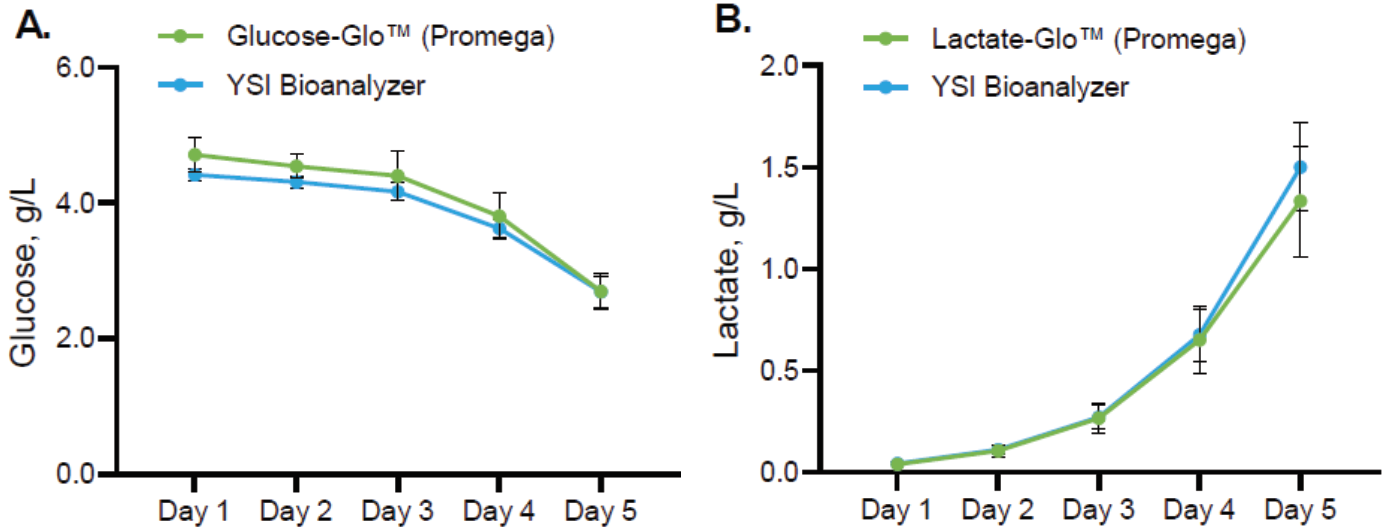
BioBLU® 0.3cシングルユースバイオリアクターでDASbox®ミニバイオリアクターシステムにより制御された条件下で、hADSCを5日間培養した際のグルコース消費 (パネルA) と乳酸分泌プロファイル (パネルB) 。データは6基のバイオリアクター(n=6)の平均を示しており、Glucose-Glo™ と Lactate-Glo™ アッセイがYSIバイオアナライザーによる結果と同様のプロファイルを示したことがわかります。
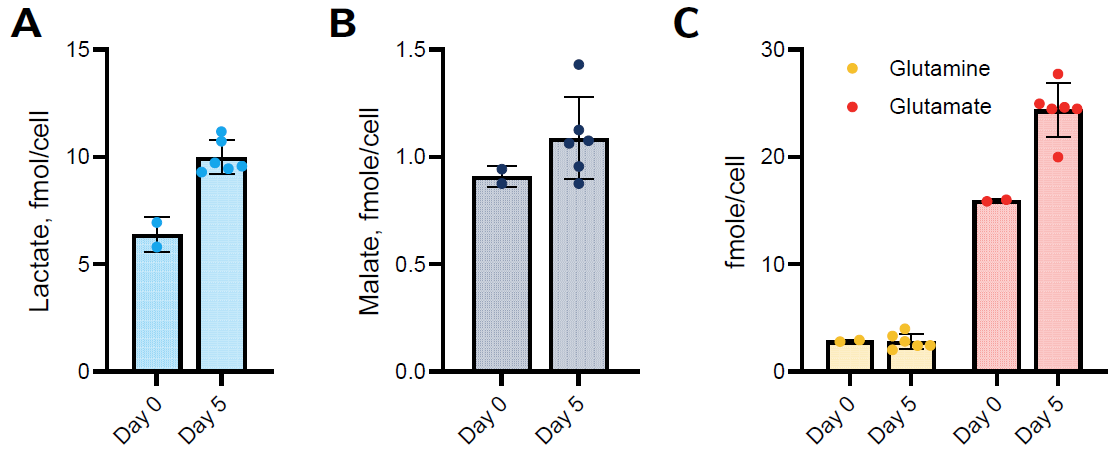
細胞内代謝物レベル 細胞は5日目にマイクロキャリアから回収され、0日目のデータと比較されました。3,000個の細胞を各ウェルに分注し、384ウェルの低容量プレートでアッセイを実施しました。乳酸(パネルA)、リンゴ酸(パネルB)、およびグルタミン/グルタミン酸(パネルC)は、代謝物検出アッセイを用いて測定されました。データは6基のバイオリアクター(n=6)の平均を示しています。